
作者:夏禹 转自:E药经理人
从1986年第一个单抗诞生到如今,单抗药物已经进入第四代。在全球最畅销的前十药品中,单抗产品占据了半壁江山。而在国内,近期政策从审批速度、临床试验、医保覆盖与支付、税收水平、融资渠道上进行优化,单抗类企业发展加速。
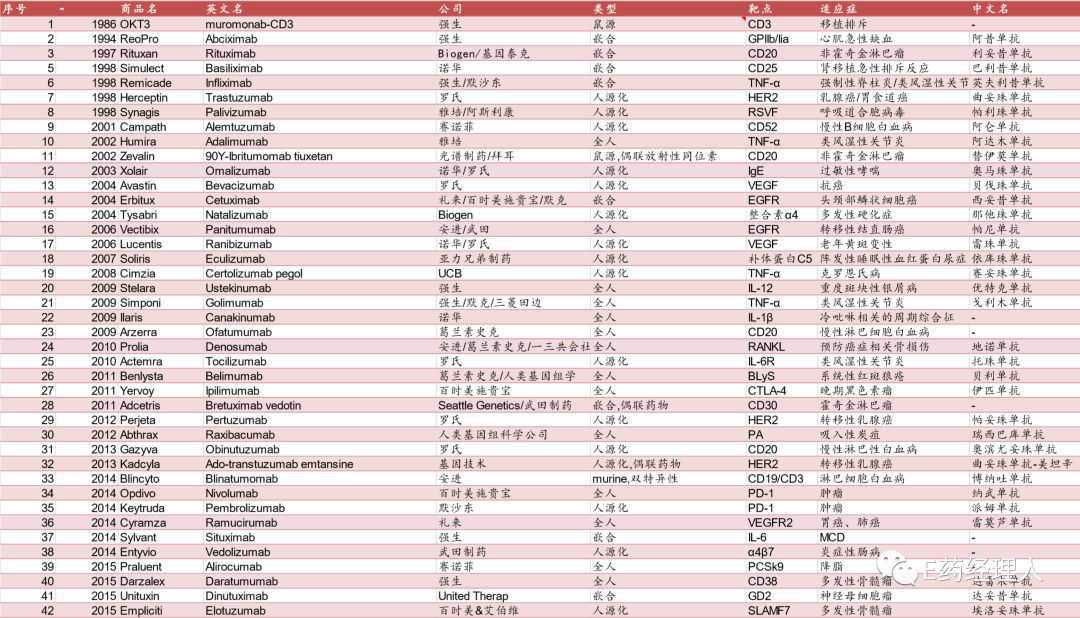
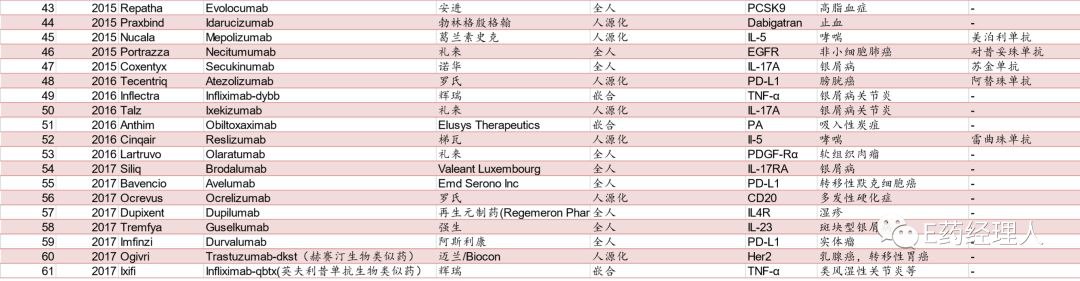
从 1986 年-2017 年,FDA 共批准了六十余个单抗产品 (不含退市的单抗产品)。2017 年全球前十大畅销药物中,化药占 3 席,生物药占了 7 席,其中 5 个品种为单抗产品。单抗也从来不缺乏重磅产品,自1986年全球首个单克隆抗体OKT3获得美国FDA的上市批准,经过三十多年的快速发展,单抗药物目前已经成为全球生物制药增长最快的细分领域,诞生了数个年销售额超过50亿美元的“超级重磅药物”。
其中最为我们所熟知的就是BMS的Opdivo 和默沙东的Keytrud。自2014年上市以来,仅3个完整年度,2017年合计销售额已达87.57 亿美元。BMS的 PD-1 单抗 Opdivo2014 年上市,目前已成为全球第 11 大畅销药,销售额仅次于利伐沙班。
反观国内,单抗市场仍以进口产品为主,80%以上市场为进口抗体占据,进口抗体:国产抗体销售额体量约为 5:1。2012年以来国产抗体、进口抗体销售额保持持续增长,年增速 15%左右。
不仅如此,国内单抗获批数量也远远落后。截止至 18 年,CFDA 目前共批准 29 款单抗(含融合蛋白),其中 19 款为国外 进口产品,10 个为国产(扣除掉融合蛋白类产品之后仅 6 个),远小于 FDA 批准的61款的数量。
2018年被称为国内单抗的“上市元年”。据统计,中国抗体类似物数量已经跃居世界第一位,但是靶点集中、竞争相对激烈,不过在资本、人才、政策的驱动下,国内抗体药物市场呈现百家齐鸣状态。抗体药物品种申报呈现研发品种密集、研发时间密集、参与企业多样等特点。
三生制药
中信国健是国内最早的一批单抗类企业,属于“既有上市单抗产品又有研发管线”的企业。目前有 2 款上市的抗体类产品,益赛普(依那西普类似药)于 2005年上市,健尼哌(达利珠单抗类似药)于 2011 年上市。2014年其销售额接近 8 亿元,扣非净利润超过 2 亿。
公司被三生制药收购后更名为三生国健,并添加生物药的 CDMO业务。三生制药自收购中信国健以后生物药版图扩大,目前研发管线中有 7 个单抗类肿瘤治疗项目、3 个单抗类自身免疫病项目和1个眼科疾病项目,其中 302H(人源 化抗 Her2 单抗)正在完善临床研究报告并准备提交新药申请,304R 也处在新药审 评阶段。
9月份,国家食药监局受理了三生国健药业递交的注射用重组抗HER2人源化单克隆抗体(赛普汀)的上市申请,赛普汀或成为国内首个上市的曲妥珠单抗生物类似物。
作为罗氏旗下的王牌药品,赫赛汀在2015年、2016年在全球的销售额分别达到了65.38亿美元和67.82亿美元,其在2017年的销售额更是达到了72.65亿美元。也正是因为巨大的市场前景,目前赫赛汀成为了生物类似药的研发成为热点。
除了三生制药外,包括康宁杰瑞、丽珠生物、百奥泰生物、荣昌制药等均在此产品上进行了布局。因而,三生制药能够率先提交上市申请,无疑是比其他竞争对手抢先了一步。若能顺利完成上市,对于前者来说,将会是极大利好。
复宏汉霖
复宏汉霖是国内单抗药物研发的领先企业,单抗研发管线丰富。公司目前共有11个产品、17项适应症申报临床试验,多个产品进入了III期临床试验。HLX01(美罗华类似药,CD20单抗)已经报产,III期临床数据良好,并已经完成三合一审评,预计即将获批,有望成为国内首个获批的生物类似药。
根据科技部发布的2017 年中国独角兽企业发展报告,复宏汉霖估值为 31.8 亿 美元,排名第 30 位。复宏汉霖是目前 III 期临床进展最快的企业之一,共有 9 个单抗 品种,重组抗 CD20 单克隆抗体注射液申报生产并纳入优先审评审批程序药品注册申请名单; 3 个单抗产品进入临床 III 期,即重组抗 VEGF 人源化单克隆抗体注 射液、重组抗 TNF-α 全人单克隆抗体注射液、注射用重组抗 HER2 人源化单克隆抗 体。
除此之外,公司的重组人鼠嵌合抗 CD20 单克隆抗体注射液(类风湿性关节炎)、重组抗 TNFα 人源化单克隆抗体注射液(类风湿性关节炎)、重组抗 VEGF 人 源化单克隆抗体注射液(非小细胞肺癌)、重组抗 EGFR 人源化单克隆抗体注射液(实体瘤)进入临床 I 期。
信达生物
10月初,信达发布公告称,公司开发的重组全人源抗CD47单克隆抗体(IBI188),已获得美国食品和药物管理局(FDA)颁发的药物临床试验批件,拟用于治疗晚期恶性肿瘤和淋巴瘤。IBI188是信达生物第2个获得美国FDA批准进入临床研究的产品。信达生物是第一家获得美国FDA批准CD47单抗进入临床研究的中国生物制药公司。
科技部的独角兽报告中,信达生物的估值为 10 亿美元。信达生物的在研产品中,抗 PD-1 单抗(信迪利单抗)完成了 III 期临床,目前已经提交上市申请,信达生物同时使用国内数据向 FDA 提交美国新药临床研究申请(IND),已经获得 FDA 的临床许可,并且准许跃过 I 期临床;其申报的适应症为霍奇金淋巴瘤,与进口的百 时美施贵宝抗 PD-1 单抗适应症不同(后者为非小细胞肺癌)。
另外三个生物类似药处 于临床 III 期,抗 TNF-α 单抗、抗CD20 单抗、抗 VEGF 单抗处在临床 III 期,3 个 药物预期将在 2019-2020 年陆续提交新药申请。抗 CTLA-4 单抗、抗 PCSK-9 单 处在临床 I/II 期;另有若干品种除在临床前以及申报 IND 阶段。目前信达生物有 3 个临床 III 期项目,研发支出提升至 6 亿元。
君实生物
君实生物近日发布公告称,该公司及其子公司已经收到国家药品监督管理局颁发的关于其重组人源化抗PD-L1单克隆抗体注射液(研发代号“JS003”)的《药物临床试验批件》。
JS003 是君实生物开发的针对PD-L1蛋白的人源化单克隆抗体,可以结合PD-L1并阻断PD-L1与PD-1的结合,具有治疗多种类型肿瘤的潜力。另外,君实生物的PD-1抗体特瑞普利单抗的上市申请已于今年3月获得国家药监局受理,并在今年4月被纳入优先审评程序。
君实生物之前是全国中小企业股份转让系统上市企业,市值 129 亿,目前准备在香港联合交易所主板挂牌上市。公司产品储备包括 PD-1 单抗,目前提交的新药申请已经获得 CFDA 受理,TNF-α 单抗进入临床 III 期,单抗、抗 BLyS 单抗处在临床 I 期。

