日前,Sage Therapeutics公司宣布,FDA咨询委员会以17:1的投票结果,推荐FDA批准该公司研发的用于治疗产后抑郁症(PPD)的Zulresso(brexanolone)上市。如果获得批准,这将是第一款针对PPD的获批药物。

PPD是分娩之后最常见的医学并发症,据统计在美国每9名分娩妇女中就有一位受到PPD的困扰。每年大约有40万名女性受到这一并发症的影响。PPD的症状包括忧伤、焦虑、易怒、和孤僻,严重情况下可能会有自残甚至伤害宝宝的想法。目前没有FDA批准的针对PPD的疗法,PPD患者需要更好的药物疗法缓解她们的症状。
Zulresso是Sage公司研发的一种GABA-A受体变构调节剂。对神经递质受体的变构调节能够将受体活性调节到不同的水平,而不是完全激活或者抑制这些受体。Zulresso已经获得了FDA的突破性疗法认定和欧洲药品管理局的PRIME药品认定。
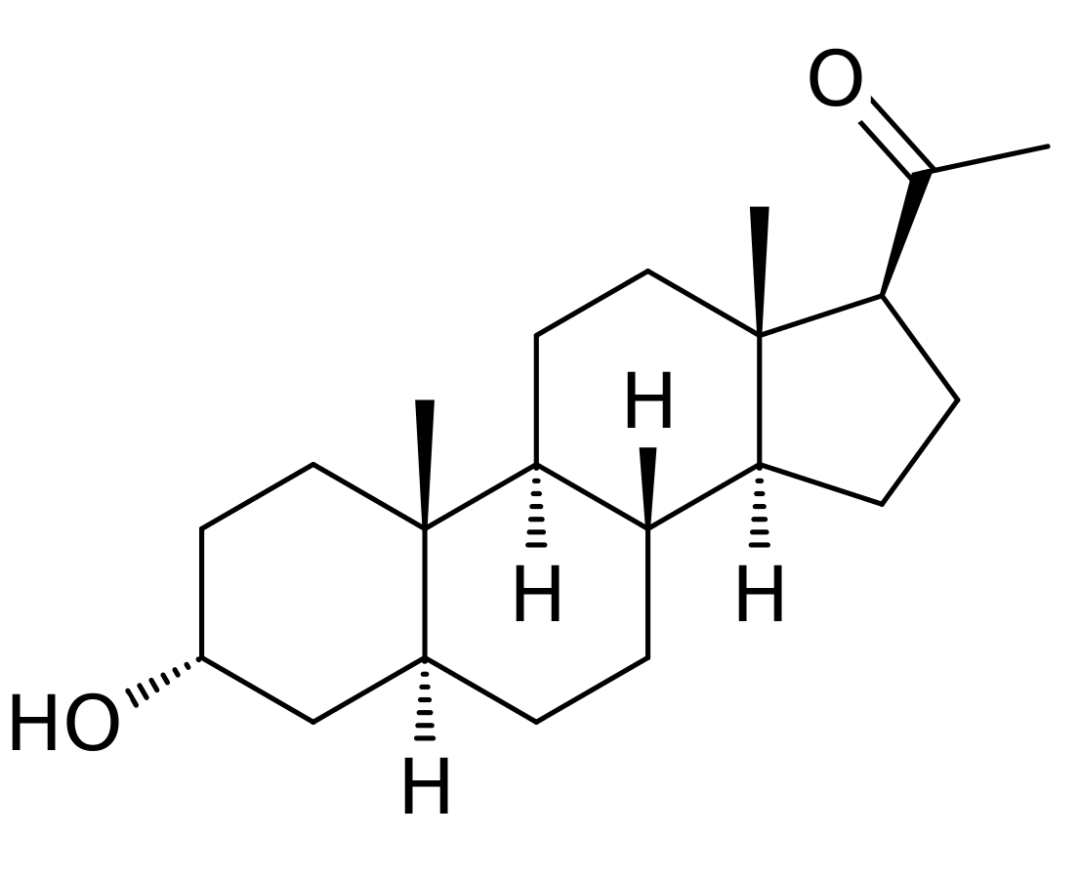
▲Zulresso分子结构(图片来源:By Ed (Edgar181) [Public domain], from Wikimedia Commons)
Zulresso在已经完成的两项多中心,随机双盲,含安慰剂对照的3期临床试验中达到了其主要终点。与安慰剂相比,显著降低患者的抑郁症症状(根据抑郁症汉密尔顿评定量表)。
“我们很高兴FDA咨询委员会支持Zulresso作为治疗PPD的创新疗法。受到PPD症状困扰的妇女和她们的家人需要一种创新疗法选择来迅速缓解症状,”Sage公司的首席执行官Jeff Jonas博士说:“这是Sage公司在将革命性创新疗法带给患者的道路上迈进的重要一步。”
FDA在今年5月30日接受了Zulresso的新药申请(NDA)并且授予其优先审评资格。这意味着该药物有望在今年12月19日以前获得批准,为受到PPD困扰的妈妈们献上一份圣诞礼物。
参考资料:
[1] Sage Therapeutics Announces FDA Advisory Committee Votes 17-1 in Support of Benefit-Risk Profile of ZULRESSO™ (brexanolone) Injection for Treatment of Postpartum Depression. Retrieved November 5, 2018, from https://www.bizjournals.com/boston/businesswire/press_releases/Massachusetts/2018/11/02/20181102005585
[2] Sage Therapeutics. Retrieved November 5, 2018, from https://www.sagerx.com/

