总部位于马萨诸塞州的TCR2 Therapeutics日前已向美国证券交易委员会(SEC)递交了IPO申请,拟募资1亿美元。TCR2成立于2016年12月,A轮即获得4450万美元的融资。2018年3月,该公司B轮又完成1.25亿美元的融资,用于已通过临床概念验证的两项T细胞受体计划的推进。

TCR2是一家免疫疗法公司,专注于使用其多格式TRuC平台开发新型T细胞疗法。TCR2在向美国SEC提交的报告中提到,虽然美国FDA已批准两款CAR-T疗法用于某些CD19阳性B细胞血癌,但其使用比较受限制。此外,到目前为止,尚未证实CAR-T在靶向实体瘤方面是有效的。TCR2认为其所开发的项目可以改变这一点,其独有的T细胞受体(TCR)平台能对天然的TCR复合体进行重编程,不但有望快速并持久地杀死癌细胞,还能保持较低的细胞因子释放。此外,这类创新技术无需HLA匹配,就能让T细胞识别肿瘤细胞。在临床前试验中,相比CAR-T疗法,其TCR疗法对多种实体瘤展现出了更优的活性。
在其递交的IPO申请文件中,TCR2表示已向美国FDA提交了其主打候选药物TC-210用于治疗实体瘤的新药临床试验申请(IND)。该公司计划启动1/2期试验,以治疗间皮素阳性实体瘤患者,初步数据预计将在2019年下半年公布。在申请文件中,该公司还表示,预计TC-210的患者人数在美国约为81,000人。TC-210是一款能靶向表达间皮素的肿瘤T细胞疗法,间皮素是一种肿瘤分化抗原,在几种癌症中高度表达,包括恶性间皮瘤、胰腺癌、卵巢癌和肺腺癌。
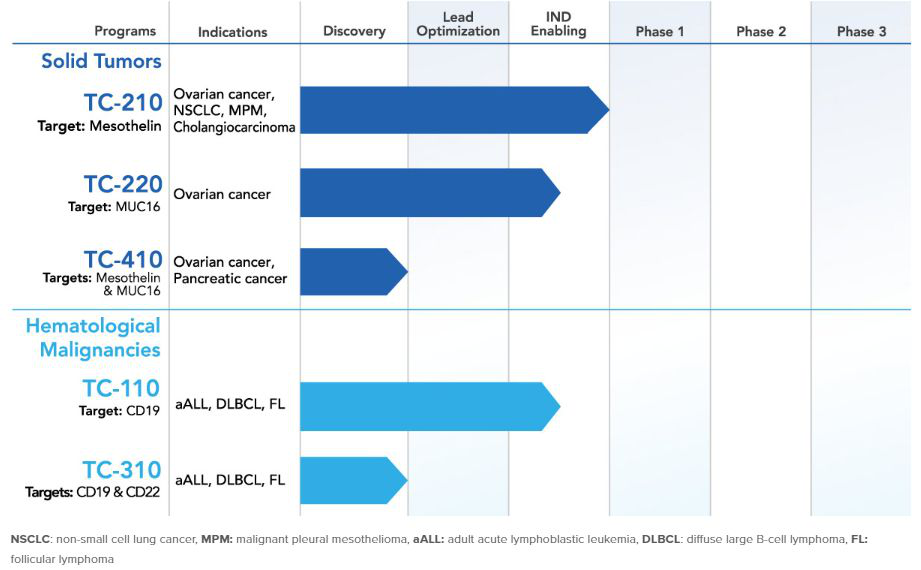
TCR2 Therapeutics的研发管线(图片来源:TCR2 Therapeutics官网)
TCR2表示,计划在今年晚些时候为其血液学候选药物TC-110提交第二个IND。该药物主要用于治疗CD19阳性B细胞血液系统恶性肿瘤。该公司预计试验的初步数据将在2020年公布。此外,TCR2还计划在2020年为其第二个实体瘤药物TC-220提交IND。
继CAR-T疗法在2017年获FDA批准后,TCR疗法近期又吸引了诸多医药人的目光。我们期待TCR2在本轮融资的助力下,能加快TCR疗法的开发,早日为诸多癌症患者带来创新疗法!
参考资料:
[1] TCR2 Shoots for $100 Million IPO in Early 2019 Retrieved on January 3 2019 from https://www.biospace.com/article/tcr2-starts-2019-by-filing-for-an-ipo/
[2] TCR2 Therapeutics website Retrieved on January 3 2019 from https://www.tcr2.com/

