德琪医药近日宣布,公司一类创新药ATG-010(selinexor)已获得国家药品监督管理局的临床试验批件,目标适应症为接受过含免疫调节剂和蛋白酶抑制剂方案的难治复发多发性骨髓瘤。据悉,selinexor是全球首款用于治疗难治复发多发性骨髓瘤的选择性核输出抑制剂(selective inhibitor of nuclear export, SINE),也是全球首创的SINE口服抗癌药物。2018年5月,德琪医药从Karyopharm公司取得了这款创新药在亚洲不同国家和地区的开发和商业化的独占许可。
值得一提的是,这款药物在中国获批临床,成为德琪医药继肝癌治疗新药ATG-008启动临床试验后,第2款在中国大陆获批临床的新药,也是德琪医药在创新药开发征程中的又一大进展。

Selinexor是一款全新靶点、全新机制的抗癌新药。资料显示,该药物通过结合并抑制核输出蛋白XPO1(也称为CRM1)而起作用,并导致肿瘤抑制蛋白在细胞核中累积,从而重新启动和放大其作为肿瘤抑制剂的功能,导致癌细胞中的细胞凋亡的选择性诱导,同时很大程度上让正常细胞免受损伤。
在中国,随着这款药获批临床,德琪医药针对其目标适应症的临床试验也即将启动。据悉,该临床试验为一个开放性、单臂临床研究,主要目的是评估ATG-010联合低剂量地塞米松在既往接受过含免疫调节剂和蛋白酶抑制剂方案的难治复发多发性骨髓瘤患者中的药代动力学特性、有效性及安全性耐受性。
在全球,针对selinexor的申报注册也在加速。据悉,迄今已有超过2800名患者接受了这款药的治疗。Selinexor已被授予多发性骨髓瘤的孤儿药物的称号以及快速审评通道资格。而且,Karyopharm公司已启动selinexor用于治疗五线复发多发性骨髓瘤患者新药上市申请(NDA)的滚动递交(rolling submission),且在2019年初向欧洲药品管理局(EMA)递交加速评估新药上市申请。
Selinexor可用于治疗多种血液肿瘤和实体肿瘤。除了多发性骨髓瘤,Karyopharm公司针对这款药正在进行涉及弥漫性大B细胞淋巴瘤、脂肪肉瘤、子宫内膜癌等多种癌症适应症的多项中期和后期临床试验。在中国,德琪医药近期也已向药监机构提交了第二个适应症——用于治疗难治复发弥漫性大B细胞淋巴瘤的临床试验申请。
德琪医药公司创始人、董事长梅建明博士表示:“对于难治复发的多发性骨髓瘤,中国患者亟需一种新的作用机制的创新疗法。经过前期合作伙伴美国Karyopharm及各位同事的不懈努力,经过同国内外血液肿瘤专家密集深入的沟通,此次ATG-010顺利获得临床研究批件,标志着口服ATG-010离中国患者又近了一步。”
德琪医药是一家专注于新药开发,临床研究和市场销售的创新药公司,专注于解决亚洲地区未被满足的医疗需求,并力争为中国及亚太地区的患者提供最前沿和领先的抗肿瘤和抗病毒创新药物。目前,德琪医药拥有五个临床研发阶段的产品:
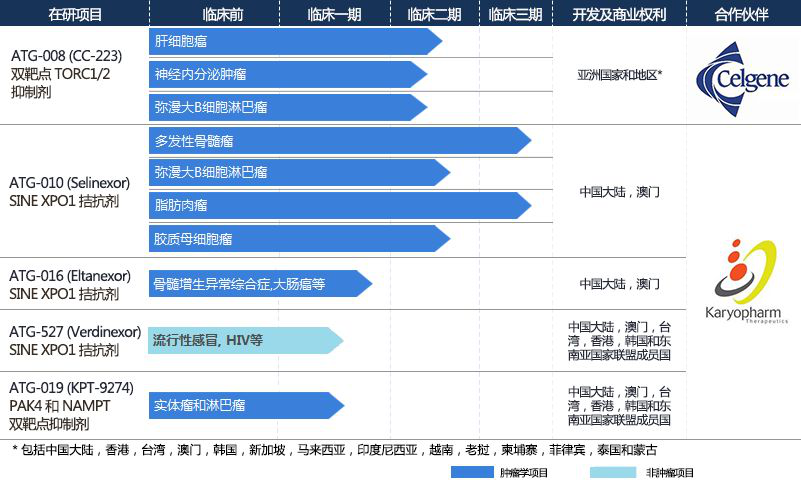
德琪医药研发管线(图片来源:德琪医药公司官网)
ATG-010是一款在多发性骨髓瘤(multiple myeloma, MM)、弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)及多种实体瘤分别处于NDA申报及临床2/3期阶段的在研产品;
ATG-008已在包括中国大陆、中国台湾和韩国在内的多个地区开展亚太多中心肝癌临床研究;
ATG-016和ATG-019是两款处于临床1/2期阶段的专注于癌症治疗的新靶点和机制的在研产品,正在进行关于治疗包括骨髓增生异常综合征(myelodysplastic syndrome,MDS)、结肠直肠癌、前列腺癌在内的多个癌症种类的临床研究;
ATG-527是一款临床在研抗病毒药品,目前正在进行关于治疗流感、呼吸道合胞病毒(RSV)及人类疱疹病毒(EBV)感染等相关疾病的临床研究,并已完成1期临床研究。
德琪医药表示,2019年公司将有多款产品进入2/3临床阶段,将会是临床批件的“丰收年”。对于患者来讲,只有药物早日上市,才能分享全球创新药物的研发成果,所以,今年依然是一个“播种年”。公司一切努力的最终目的,就是让临床试验用药早日造福中国和亚太患者。
参考资料:
[1]ATG-010,中国首个用于治疗多发性骨髓瘤的选择性核输出抑制剂获批临床批件 . Retrieved Feb 12from 德琪医药官微

