药物:CAR-T疗法
杂志:Nature
亮点:一个巧妙的设计,让CAR-T疗法抗癌能力大增
越来越多的癌症患者正在接受CAR-T细胞疗法的治疗。
CAR,英文全称为Chimeric Antigen Receptor,即,嵌合抗原受体,是一种能够特异性识别癌细胞的“导航”;T是发挥杀伤癌细胞作用的T细胞。
简单来说,CAR-T疗法是指,从患者体内分离出T细胞,然后在体外对T细胞进行改造,使其表达能够识别癌细胞的CAR,接着将这类CAR-T细胞进行扩增,最后回输到患者体内,发挥抗癌作用。

淋巴细胞正在攻击癌细胞(图片来源:La Jolla Institute)
目前,CAR-T疗法在治疗血液学肿瘤方面取得令人瞩目的成绩。全球已有两款CAR-T疗法获批上市,分别是诺华的Kymriah和Kite Pharma的Yescarta,可用于治疗急性淋巴细胞白血病和特定类型的非霍奇金淋巴瘤。
然而,在实体瘤治疗方面,CAR-T疗法的表现却不尽如人意。这部分是因为,当CAR-T细胞进入实体瘤后可能会因为一种叫做T细胞耗竭的现象而停止杀伤肿瘤细胞的工作。

图片来源:Nature
2月27日,最新发表在Nature[1]杂志上的一项研究中,来自美国La Jolla免疫学研究所的科学家们找到了一种对抗T细胞耗竭的新方法,使得CAR-T疗法的疗效大大提升。
他们的研究表明,一种名为Nr4a转录因子的蛋白质家族在调控与T细胞耗竭有关的基因方面发挥着重要作用。动物实验表明,用不表达Nr4a转录因子的CAR-T细胞进行治疗使得小鼠肿瘤更小,存活地更久。

Anjana Rao教授(图片来源:La Jolla免疫学研究所)
具体来说,为了调查CAR-T细胞在实体瘤中的功能,La Jolla免疫学研究所的Anjana Rao教授等用CAR-T细胞治疗了hCD19阳性荷瘤小鼠。分析显示,表达免疫抑制性受体PD-1和TIM3的“CD8+CAR+肿瘤浸润淋巴细胞“和”CD8+内源性肿瘤浸润淋巴细胞“表现出了相似的基因表达特征和染色质可及性。这与核受体转录因子NR4A1 (NUR77)、NR4A2 (NURR1)和NR4A3 (NOR1)的二次激活有关。
进一步的研究显示,来自癌症或慢性病毒感染患者的CD8+ T细胞表达了高水平的NR4A转录因子。缺失所有三种NR4A转录因子(Nr4a三敲除)的CAR - T细胞可促进肿瘤消退,延长荷瘤小鼠的生存期。
大多数接受“删除Nr4a的CAR-T细胞”治疗的小鼠存活了下来,且在为期90天的实验过程中,它们的肿瘤实现消退并保持在较小的体积。相比之下,几乎所有接受“Nr4a正常表达的CAR-T细胞”治疗的小鼠在实验第35天时死于肿瘤。
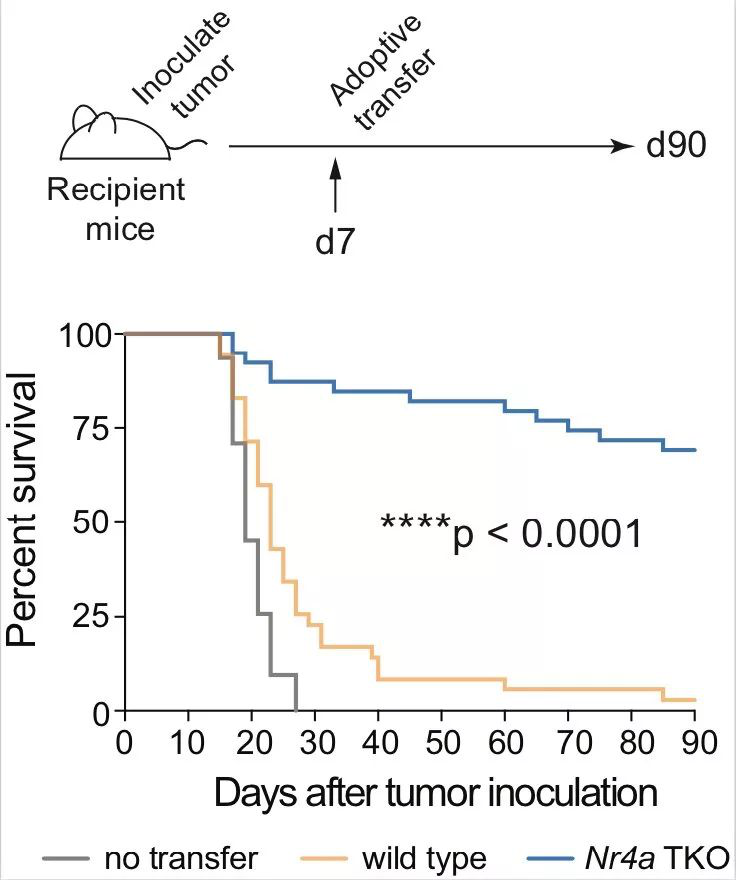
缺乏Nr4a转录因子的CAR - T细胞能逆转肿瘤,延长小鼠的生存期。(图片来源:Joyce Chen, LaJolla Institute for Immunology)
研究者们认为,证明转录因子在T细胞耗竭中发挥重要作用是非常令人鼓舞的发现。尽管他们的研究和临床之间还有很远的距离,但这些发现丰富了改善癌症免疫疗法的知识库,有望帮助解决CAR-T疗法对实体瘤疗效不佳的困局。抑制NR4A是一种有前途的癌症免疫治疗策略。未来,他们将继续研究其它转录因子在T细胞耗竭中的作用,尤其是那些直接受NFAT和Nr4a影响的转录因子。
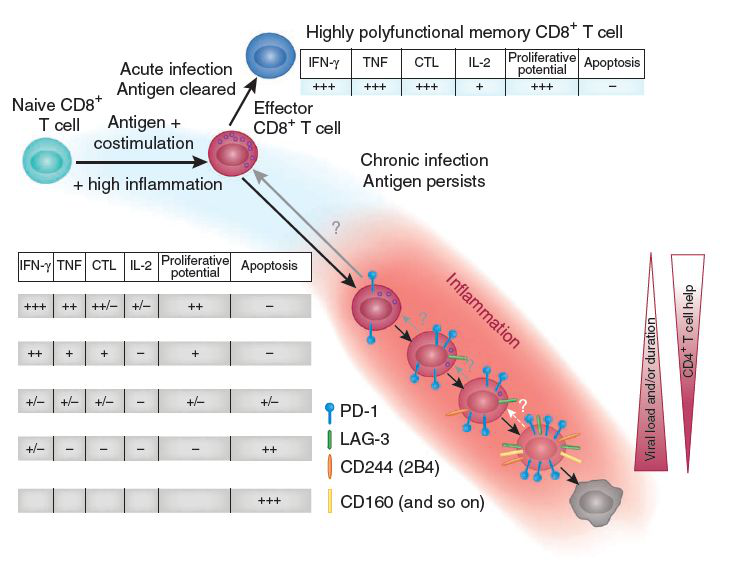
初始CD8+T细胞应对急性感染和慢性感染的不同走向(图片来源:Nature Immunology)
目前,全球还有很多其他科学家团队在围绕T细胞耗竭开展研究。这种由慢性抗原刺激所致的T细胞功能障碍发生在许多慢性感染和癌症中,表现为效应功能低下或丧失以及免疫抑制性受体表达上调[2]。耗竭状态的T细胞会阻碍免疫系统对感染和肿瘤的最佳控制,而免疫检查点阻断介导的耗竭T细胞的再生已成为治疗多种癌症的有效方法。
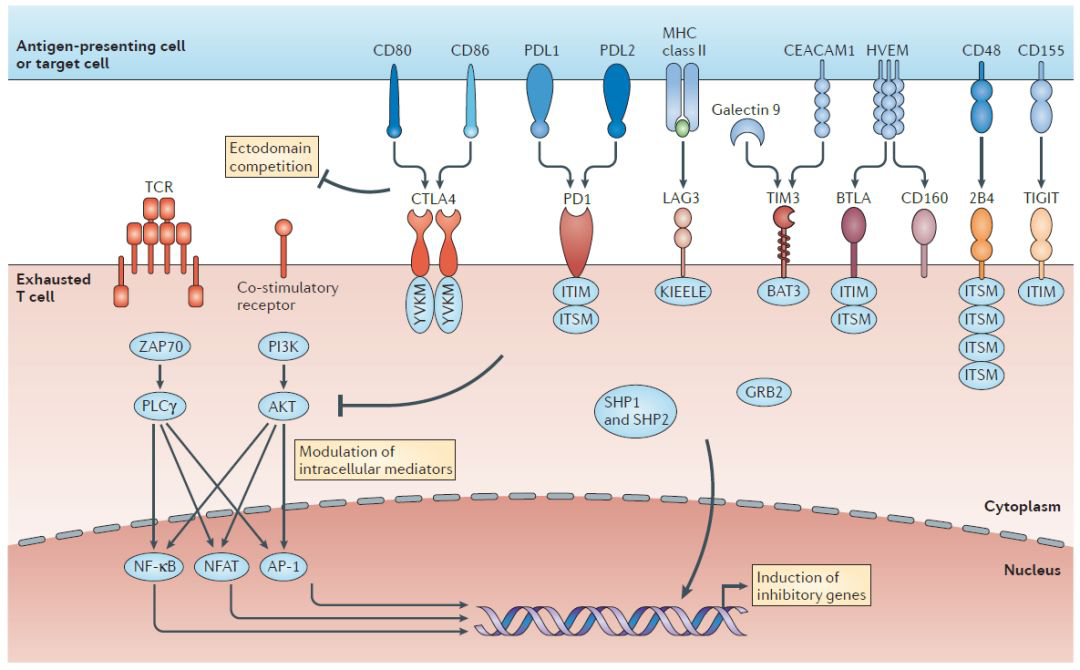
与T细胞耗竭相关的抑制性受体分子通路[6](图片来源:Nature Reviews Immunology)
不过,大多数癌症患者一开始对免疫检查点阻断疗法(如PD-1/PD-L1抗体)响应很好,但这种响应并不持久。这是为什么呢?

论文封面:背景是功能性T细胞(绿色),前景是耗竭T细胞(灰色)(图片来源:Science)
宾夕法尼亚大学医学院的E John Wherry博士等在2016年发表的2篇Science论文[3][4]中回答了这一问题。

阻断PD-1/PD-L1的相互作用对耗竭T细胞的表观遗传学特征影响甚微。(图片来源:Science)
研究发现,耗竭T细胞的表观遗传学特征与效应T细胞和记忆T细胞存在显著差异(后两种细胞能够对病毒和肿瘤产生有效的免疫应答,尤其是记忆T细胞,会产生持久的作用)。而阻断PD-1只能使耗竭T细胞的表观遗传学特征发生微小的变化。
科学家们认为,可能正是耗竭T细胞表观遗传学命运的不可逆性限制了PD-1/PD-L1检查点抑制剂的疗效。
基于这一发现,Wherry博士等提出,或许可以通过表观遗传药物与免疫检查点抑制剂的联合,将耗竭T细胞在表观遗传水平重编程为效应持久的功能性记忆T细胞。

图片来源:Cell
这一设想在2017年发表的一篇Cell[5]论文中得到了验证。美国St. Jude儿童研究医院的Ben Youngblood博士带领的团队证实,可抑制DNA甲基化的化疗药物地西他滨(decitabine)能够扭转与表观遗传相关的T细胞耗竭。
当研究人员用地西他滨处理肿瘤小鼠时,T细胞显示了增强的活性,逆转了耗竭的状态;接着再用PD-1抑制剂处理小鼠,小鼠的T细胞增殖积极,且具有新生T细胞的活力。而这种增强的T细胞增殖与肿瘤生长被显著控制有关。
Youngblood博士等认为,这些结果证明了结合表观遗传重编程和免疫检查点阻断有望提高抗癌免疫疗法的疗效。
结合最新发表的Nature论文,可以发现,不管是CAR-T疗法,还是免疫检查点抑制剂,结合其它办法来更好地调动或改变耗竭T细胞是提高疗效以及扩大适用人群的重要方向。
相关论文:
[1]Joyce Chen et al. NR4Atranscription factors limit CAR T cell function in solid tumours. Nature(2019).
[2]E John Wherry. T cell exhaustion.Nature Immunology(2011).
[3]Kristen E. Pauken etal. Epigenetic stability of exhausted T cells limits durability ofreinvigoration by PD-1 blockade. Science(2016).
[4]Debattama R. Sen etal. The epigenetic landscape of T cell exhaustion. Science(2016).
[5]HazemE. Ghoneim et al. De Novo Epigenetic Programs Inhibit PD-1 Blockade-Mediated TCell Rejuvenation. Cell(2017).
[6] E. John Wherry et al.Molecular andcellular insights into T cell exhaustion. Nature Reviews Immunology(2015).
参考资料:
1# Scientistsdevise strategies to counteract T cell exhaustion in CAR T cancer therapies
2# Stabilityof exhausted T cells limits durability of cancer checkpoint drugs
3# Researcherschart pathway to 'rejuvenating' immune cells to fight cancers and infections
4# 《科学》封面重磅:一个关于T细胞悲伤而重要的研究丨奇点猛科技
5# Cell:免疫疗法不起效?化疗药物来助攻!

