日前,科望生物医药科技有限公司宣布,双特异性抗体ES101获得中国国家药监局药品审评中心(CDE)临床试验默示许可,即将在中国开展临床试验。

ES101是一个first-in-class、四价双特异性抗体。它包含4个结合域,其中两个靶向PD-L1,另外两个靶向4-1BB。然而其分子量仅是常规抗体的三分之二。基于PD-L1在肿瘤微环境中高表达这一生物学特性,结合抗体工程学独特设计,ES101能够在有效持续阻断PD-L1的同时,在肿瘤微环境中有条件激活4-1BB。这一“去刹车”与“加油门”的组合不仅很大程度提高了药物的疗效,而且避免了4-1BB单药的毒性,解决了此前类似单抗药物在临床研发中的难题。
ES101(又名INBRX-105)项目的美国合作伙伴Inhibrx也于近日宣布在美国完成第一例患者给药。这意味着ES101双特异性抗体将在中美两地同步开展临床试验,有望惠及全球癌症患者。
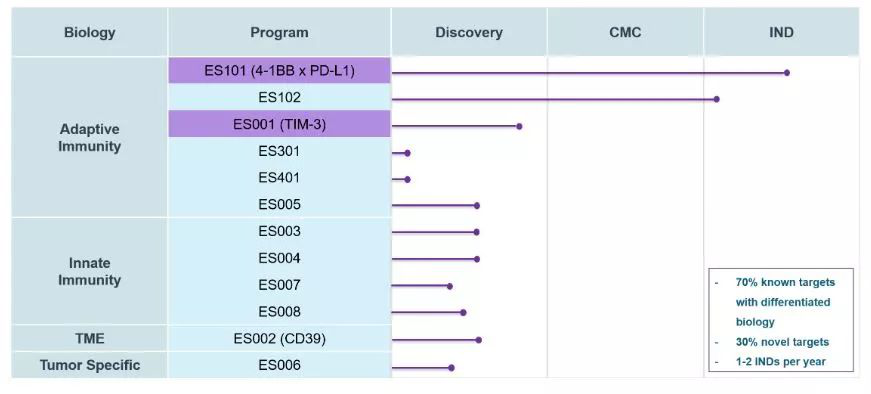
▲研发管线(图片来源:科望生物公司官网)
Inhibrx首席科学官兼执行副总裁Brendan Eckelman博士说:“INBRX-105旨在实现‘检查点反转’的机制概念,其中治疗候选物充当适配器,通过局部激活4-1BB将PD-L1介导的免疫抑制信号转化为免疫刺激反应。”
科望医药CEO纪晓辉博士表示:“ES101 代表着下一代肿瘤免疫治疗的到来。这是一个全球首创的双特异抗体新药,期待为肿瘤患者带来PD-1/PD-L1之后的全新的治疗方案。 我们开心地见证这个历史的时刻,相信这是科望的一小步, 患者的一大步。”
值得一提的是,药明康德测试事业部WIND平台协助了这款新药IND的中美双报。我们祝愿这款新药的临床研究顺利,早日为患者带来新的治疗选择!

