自全球首款CAR-T治疗产品Kymriah在美国获批上市后,细胞治疗就以突出的疗效备受行业瞩目。近日,CAR-T疗法的开发在中国频传捷报。由信达生物与驯鹿医疗联合开发的全人源抗BCMA CAR-T细胞治疗复发/难治性多发性骨髓瘤的临床研究数据亮相ASCO和EHA年会,研究所展示的积极数据更是惊艳全场——客观缓解率(ORR)达100%!
6月19日,科济生物宣布其自主研发在研产品—CT053全人抗BCMA自体CAR-T细胞注射液用于治疗复发难治多发性骨髓瘤的新药临床试验(IND)申请,已收到了美国FDA获准该产品进入临床试验的通知。
在中国,目前尚无一款CAR-T产品获批上市,但相关临床研究呈现如火如荼的发展态势。在ClinicalTrials.gov网站上,来自中国的CAR-T产品注册数量已超过160个,这一数据在2017年已超过美国。据不完全统计,目前向国家药品监督管理局递交的CAR-T产品临床申报已达26个,其中16个已获批准。

▲图片来源:Pixabay
CAR-T开发如火如荼
2018年11月,恒润达生宣布其抗人CD19 T细胞注射液在复旦大学附属中山医院完成了首例入组及采集,该患者成为了中国CAR-T产品作为药品向CDE申报注册临床试验的第一例受试者。
事实上,除了上述三家企业之外,还有数十家企业正在布局CAR-T疗法这一领域。包括传奇生物、恒润达生、复星凯特、成都银河生物、科济生物、明聚生物、中国医学科学院/宝日医生物等企业的CAR-T产品已在多个肿瘤中开展临床,涉及适应症有多发性骨髓瘤,肝细胞癌,肾细胞癌,非霍奇金淋巴瘤等。
其中,科济生物具有针对多种肿瘤靶点如GPC3、CD19、BCMA、CLAUDIN18.2、EGFR/EGFRVIII等11款CAR-T细胞治疗产品,其在研产品—CT032人源化CD19自体CAR-T细胞注射液、针对GPC3靶点的CAR-T产品,以及针对BCMA靶点的CAR-T产品均已在中国获得临床试验批准。
恒润达生开展的细胞疗法也较多,已获得针对淋巴瘤、白血病、多发性骨髓瘤的3个CAR-T产品的临床批件。同时,该公司正在与美国、以色列、捷克、匈牙利等国家的相关部门机构和医院开展广泛合作,其中以色列卫生部已批准恒润达生CAR-T产品进入该国医院开展CAR-T的药物临床试验研究。
2018年6月,上海药明巨诺及其关联公司上海明聚生物宣布,明聚生物CAR-T产品JWCAR029的IND申请已获得药监局批准。根据药明巨诺公告,这是自2017年12月《细胞治疗产品研究与评价技术指导原则》发布以来,首个获准IND的以CD19为靶点的CAR-T产品。
此外,由中国企业开发的CAR-T疗法也逐渐走向全球,科济生物的案例并非中国企业首次在美国开展CAR-T疗法的临床研究。2018年5月,由杨森公司与传奇生物联合开发的靶向B细胞成熟抗原(BCMA)的CAR-T疗法,在美国启动1b/2期临床试验用于治疗复发性或难治性多发性骨髓瘤(MM)。
越来越多CAR-T产品正在进入临床开发阶段,这些革命性疗法有望为更多的癌症患者带来新的治疗希望。
细胞治疗的监管双轨制
在中国,细胞治疗曾一度进入繁荣期。2003年,国家药监局药品审评中心(CDE)颁布《人体细胞治疗研究和制剂质量控制技术指导原则》,用于指导细胞治疗类产品的研发与注册,这是细胞治疗迈向正规化的第一步。
2009年,《医疗技术临床应用管理办法》正式落地,细胞治疗被纳入第三类医疗技术中,由卫生部负责监管。此后,细胞治疗产品的监管就出现了实质上的双轨制,而大多数企业的CAR-T产品在卫生部备案后便在医院开展了临床研究。
2015年,国家卫生计生委发布取消第三类医疗技术临床应用准入审批有关工作的通知,不再对医院开展的细胞治疗进行监管。此后,细胞治疗的开发以医院为主体,并由于多种因素被短暂停止。
2016年底,国家药监局发布《细胞制剂研究与评价技术指导原则》征求意见稿,并于2017年12月以《细胞治疗产品研究与评价技术指导原则(试行)》正式发布,这意味着中国细胞治疗进入标准化和规范化时代。2018年3月,CDE也发布了《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》。
在此期间,许多企业开始将在研CAR-T产品以药品的标准和程序在CDE递交注册申请,并按照相关标准开展临床试验。如前所述,CDE收到的CAR-T产品临床申报已达26个,其中,恒润达生、科济生物和传奇生物的CAR-T产品还被纳入优先审评。在CDE临床试验默示许可一栏,已有6项CAR-T产品的临床申请获公布。
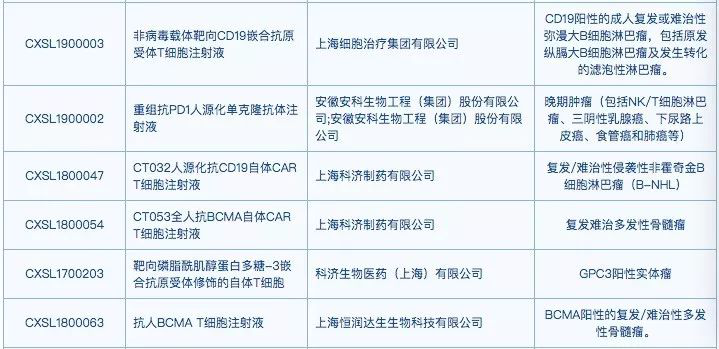
▲CAR-T产品的临床试验默示许可(图片来源:国家药品监督管理局药品审评中心)
今年初,国家卫生健康委接连发布了《生物医学新技术临床应用管理条例(征求意见稿)》与《体细胞治疗临床研究和转化应用管理办法(试行)(征求意见稿)》,文件的核心内容是三甲以上医疗机构可开展细胞治疗的研发和应用,以备案制管理。这提示CAR-T产品的监管双轨制被再次提上日程。
无论是哪一种监管路径和模式,期待这些监管措施能够促进企业开发出更加安全、有效的CAR-T疗法,从而造福广大癌症患者。

