1.多款PD-1联合疗法获临床默示许可
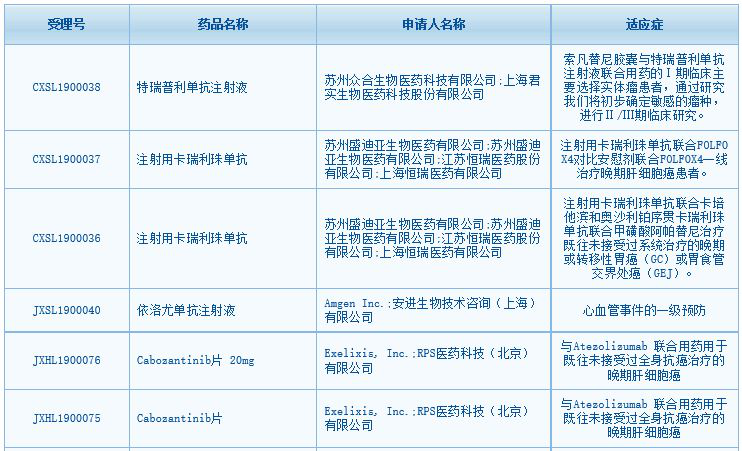
根据中国国家药监局药品审评中心(CDE)最新公示,君实生物、恒瑞医药和安进等多家公司的重磅产品的临床试验申请获得临床默示许可。其中,多项PD-1联合疗法在列。
▲图片来源:中国国家药监局药品审评中心网站截图
君实生物:索凡替尼胶囊与特瑞普利单抗注射液联合用药的1期临床主要选择实体瘤患者,通过研究将初步确定敏感的瘤种,进行2/3期临床研究。
恒瑞医药:注射用卡瑞利珠单抗联合FOLFOX4对比安慰剂联合FOLFOX4一线治疗晚期肝细胞癌患者。
恒瑞医药:注射用卡瑞利珠单抗联合卡培他滨和奥沙利铂序贯卡瑞利珠单抗联合甲磺酸阿帕替尼治疗既往未接受过系统治疗的晚期或转移性胃癌(GC)或胃食管交界处癌(GEJ)。
安进公司:依洛尤单抗注射液,心血管事件的一级预防。
Exelixis公司:Cabozantinib片,与Atezolizumab 联合用药用于既往未接受过全身抗癌治疗的晚期肝细胞癌。
2.盐野义制药与亿腾医药就芦曲波帕达成授权引进许可协议
6月24日,盐野义制药宣布公司已与亿腾医药达成协议,授权引进血小板生成素受体激动剂lusutrombopag,芦曲波帕。据悉,待产品获得批准后,双方将充分利用亿腾医药的销售网络和盐野义在全球开发和营销lusutrombopag的专长,进一步为中国患者的临床治疗做出贡献。在协议中,亿腾医药将获得在中国大陆、香港和澳门对lusutrombopag的独家授权引进许可,而盐野义将向亿腾医药生产供应该产品,并在协议签订后获得首付款,以及上市销售后的里程碑付款。双方公司在产品上市的过程中共同合作,并已开始为在中国申请获批该产品做准备。
盐野义制药有限公司总裁兼首席执行官Isao Teshirogi博士表示,这项合作对患有慢性肝病的中国患者来说是一项重大的里程碑,为严重的血小板减少症并需要侵入性手术的患者提供了一种耐受良好且有效的治疗选择。亿腾医药首席执行官倪昕先生表示,“引进全球优质产品,服务于病患的康复”是亿腾医药的愿景和使命。我们将尽所有努力推进这个产品尽早在中国上市,帮助到有凝血功能障碍患者的治疗,为病患的康复提供支持。
3.华海药业与君实生物就一款生物类似药达成合作
6月24日晚,华海药业公告宣布,其下属控股子公司华奥泰生物与君实生物于当日签订《药物技术转让与合作开发合同》,就阿瓦斯汀单抗生物类似药(HOT-1010)的后续研发、生产、上市及销售合作,以及HOT-1010与君实生物的特瑞普利单抗注射液的联合应用合作事项进行了相关约定。(具体协议条款,可点击文末“阅读原文”查看PDF原文。)
HOT-1010是一款重组人源化抗血管内皮生长因子(VEGF)单克隆抗体注射液,该产品可以选择性地与人血管内皮生长因子(VEGF)结合并阻断其生物活性,主要用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。目前该药已获得临床试验批件,正在进行1期临床。
据悉,HOT-1010药品注册成功后,药品生产技术涉及的知识产权全部由双方享有。双方将共同负责完成HOT-1010/特瑞普利单抗联合应用的临床试验(IND)申请,并由双方组成团队协同完成HOT-1010/特瑞普利单抗联合应用注册申报所需的临床试验,联合应用开发费用、后续商业化生产以及上市销售等成本和费用全部由君实生物承担。此外,就项目现有研发成果及其后续技术支持,君实生物将支付人民币9000万元。

