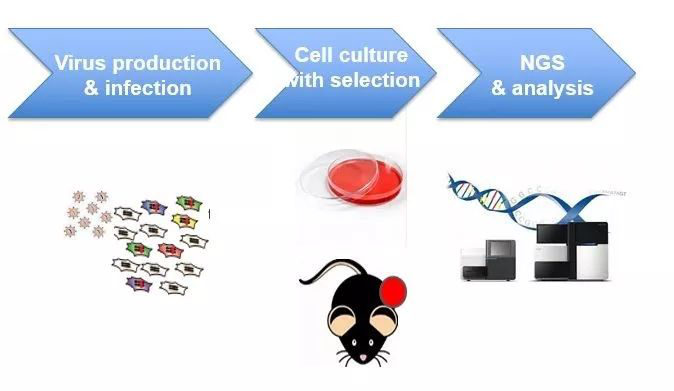
本文原载于药明康德内容部PRBP团队《药明头条》 如果说新药研发是一场漫长的渡江战役,靶标发现与验证则是位于上游的一场生死竞速。每一个成功的新药靶标,都宛如一只历尽千帆的锦鲤,经历多重体内外筛选和验证,才能从千锤百炼的实验中脱颖而出。 药明康德研究服务部(RSD)肿瘤靶标发现与验证团队,就是肿瘤靶向治疗时代的一支先遣部队。早在10年前,团队便致力于打造能力领先的一体化服务平台;而从2013年起,当CRISPR编辑技术走入科学的聚光灯下,团队敏锐地洞察到其广阔的应用前景,围绕该前沿技术,打磨、充实并优化自身平台服务能力。至今该平台已经为全球客户发现、验证数十个肿瘤靶点,不少靶点衍生的药物更已进入临床阶段,为更多突破性疗法早日问世带来了新的曙光。 高通量CRISPR体外筛选:基因剪刀手“捕鱼” 肿瘤微环境极其复杂,癌细胞基因突变纷繁无序,潜在的靶标之多堪称一个浩瀚的海洋;而通过高通量CRISPR文库筛选全新靶点,便恰似一位基因剪刀手,在茫茫大海中“捕鱼”。 2019年开年,这支团队便捧起了一尾“大鱼”。RSD肿瘤和免疫部三名博士分别作为共同第一作者与通讯作者,登上了癌症研究知名期刊《Leukemia》,发现了一类潜在全新多发性骨髓瘤治疗靶标。通过与上海科技大学和哈佛大学通力合作,团队阐明了一部分COP9信号体(CSN)亚基对免疫调节类药物泊马度胺疗效的影响。这不仅为免疫调控类药物与蛋白酶体抑制剂组合疗法提供了理论支撑,更提示CSN亚基可能作为潜在生物标记物,促进病患人群的精准治疗分型。 其实这只是该平台成立近10年来,发现、验证的数十个肿瘤靶点之一。而成就这些重磅突破的,正是前沿的高通量CRISPR-Cas9筛选技术。CRISPR编辑技术俗称为“基因剪刀手”,向导RNA则宛如基因组“GPS导航仪”,将行使“剪刀”功能的内切酶Cas9引导至目标区域进行剪辑,从而突变、沉默、或替换某些遗传元件。通过多年努力,该平台将CRISPR技术与新一代测序技术结合开发多类CRISPR文库,并在肿瘤细胞系上利用这些文库高通量筛选药物靶标。 市场上有不少商品化的通用CRISPR文库,可包含6-10万个不同的质粒载体,但这类通用文库好比巨大的“鱼池”,还需要根据客户需求定制精准的“小池”捕鱼。早期的CRISPR文库构建也充满波折与挑战,团队成员回忆道:“搭建最新的技术能力平台,需要有敢为天下先的勇气。在碰到问题时,更要删繁就简、去伪存真。参考文献选用的第一代文库并不完善,在文库构建的最初半年时间内,工作进展缓慢;但功夫不负有心人,在转用第二代文库的基础上,团队再接再厉并显著提升了数据质量,为客户打造出业界领先的CRISPR文库筛选平台。” 图:NanoDrop-One 核酸定量分析仪器 肿瘤免疫治疗新时代:CRISPR体内筛选,“锦鲤”出山 免疫疗法开创了肿瘤治疗的新时代,免疫机制研究和新靶点发现则是这个时代的“新燃料”。由于肿瘤细胞的高异质性,病人体内微环境千差万别,体内筛选也是肿瘤靶标发现环节的“大考”:将基于细胞系的体外CRISPR筛选转化为体内筛选,更能在肿瘤与免疫系统相互作用的大蓝图之下,锁定最有可能成药的精准靶标。经此一役,“锦鲤”靶标有望浮出水面;而同质化细胞系动物建模(syngeneic model)和数据降噪分析共同组成了这场“大考”。 在小鼠同质化细胞系肿瘤建模初期,研究人员曾遇到过严峻的挑战。当时大家正投入一个PD-1/PD-L1抑制剂研发服务项目,50余个小鼠模型的反应结果却极其不稳定:即便有一个样本符合要求,但是经过反复、扩大验证,同质化细胞系小鼠的药效评估反应却或高、或低,完全不能使用!难道“教科书”式的金标准出了错? 百思不得其解之后,团队成员从环境因素中找到了答案。通过调整空间密度、气流管控、饲养条件,小鼠过上了定点、定时的高规格舒适生活。事实证明只有在高度标准化环境中培养的小鼠,免疫系统才能在不同实验中,达到最大程度的一致性、稳定性,从而获取可重复、可靠的实验数据。最终团队开发了多个更适合于CRISPR体内筛选的小鼠模型,用更加专业高效的服务,赢得了客户的信任。 此外,数据降噪和解读分析对于肿瘤靶标的体内筛选也非常关键。即使是同质化小鼠模型,如果忽视模式动物的个体差异,也会影响CRISPR文库响应率、实验规模和可信度,所以肿瘤免疫部的生物信息团队接轨最新学术研究,开发了全面的分析方法,探寻有利于提升药物响应率、降低药物抗性的靶基因。 图:肿瘤靶点体内及体外筛选 稳转细胞株构建:体内外验证,“鱼”翔浅底 靶标发现的“捕鱼”工序完成之后,便需要验明“成色”:靶标相关的分子通路、相关药物与靶标作用的生物学机制、成药性研究等等,都需要经历艰苦细致的验证检测。 对靶标与药物进行检测“验明正身”,要挺过转基因细胞株测试这一关。目前市场已经拥有种类繁多的肿瘤细胞系,平台也已掌握多种手段修饰细胞株基因。在癌细胞内,多种肿瘤、免疫通路汇成了一座迷宫,可谓“牵一发而动全身”,一着错则难以成瘤。所以相关技术必须如手术刀般精准,还需要全面的肿瘤免疫学理论和多功能平台实践支持,才能在迷宫找到出口。肿瘤和免疫部各团队通力合作,不仅培养了稳定生长、临床相关性高、反应预期化的动物模型,还完成了多个高难度人源细胞的改造,为靶标验证、临床前候选药物的检测提供了高效平台支持。 近期一款重磅肺癌靶向药物即将进入临床试验,相关化合物药效分析,便使用了该平台的转基因细胞株检测服务。谈到相关细胞株的构建,大家用“好事多磨”来形容:“这是新一代靶向抑制剂,而该项目早在上一代抑制剂临床试验阶段便已启动。所以立项之初,我们就必须100%原创、构建上一代抑制剂引发的耐药突变细胞株。”在缺乏相关资料与评价标准的情况下,历经挫折与逆转,该平台终于成功构建多个鼠源、人源耐药突变的稳转细胞株。最终药物在CDX/PDX模型中也取得了良好的体内疗效,为药效评价、药物设计优化提供了坚实保障。” 回首该平台近十年的萌芽、成长与壮大,肿瘤与免疫部副总裁冀群升博士感叹:“只有具备敏锐的科学嗅觉,才能打造前沿的技术平台。挑战前沿,通常也意味更大的风险;只有千锤百炼,才能精益求精。近十年来,我们与客户互信共赢、共同成长;未来我们希望把人才梯队进一步夯实,为客户、病患和生态圈贡献更多优秀的靶标,为更多创新的肿瘤靶向疗法问世贡献力量!”