不打针?Alnylam创新siRNA口服配方获新突破
专注于开发RNAi疗法的生物医药公司Alnylam在学术会议上公布了该公司RNAi技术平台的最新突破。临床前实验结果表明,Alnylam的创新siRNA口服配方能够达到与皮下注射配方相同的效果。中枢神经系统(CNS)和眼部递送siRNA也能够长久有效地沉默基因表达。
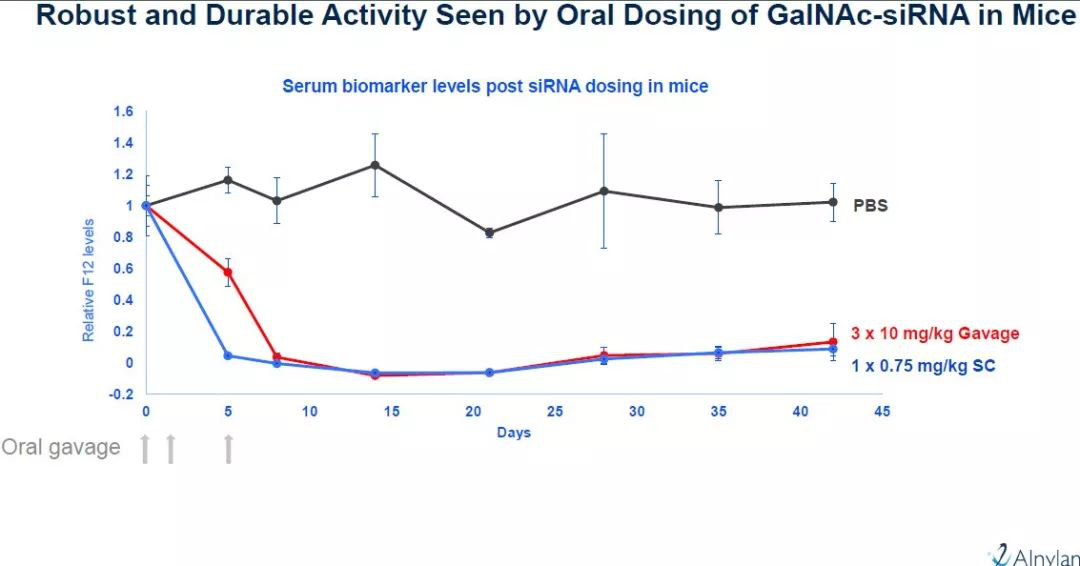
▲口服siRNA配方和皮下注射siRNA配方的效果比较(图片来源:Alnylam官网)
在概念验证实验中,研究人员将N-乙酰化半乳糖胺(GalNAc)缀合的siRNA与一种渗透增强剂(permeation enhancer)组成的独特口服配方通过口服灌胃(oral gavage)的方法递送到小鼠体内。实验结果表明,这种口服配方能够持续在肝脏中敲低基因表达40多天。基因敲低效果的持久性与皮下注射相当。3剂口服siRNA能够将基因表达敲低接近90%。
宝刀不老!艾尔建BOTOX获批第十个适应症
艾尔建(Allergan)宣布,FDA批准了其A型肉毒杆菌毒素(Botulinum Toxin A,BOTOX)扩大适应症,治疗儿童患者(2至17岁)的上肢痉挛。此外,用于治疗儿童患者下肢痉挛的扩大适应症申请,有望在2019年的第4季度得到批复。今年是BOTOX上市30周年,这是这款“老药”获得FDA批准的第十个适应症。
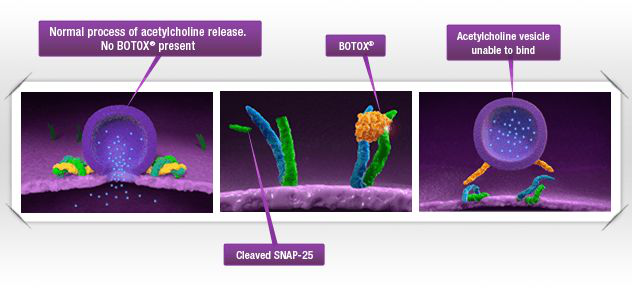
▲BOTOX的作用机理示意图(图片来源:BOTOX官网)
肉毒杆菌毒素是一种神经毒素,它作用于胆碱能运动神经末梢,拮抗钙离子的作用,干扰乙酰胆碱从运动神经末梢的释放,促使肌纤维不能收缩,,因而能降低肌张力,缓解痉挛。艾尔建开发的BOTOX是一种A型肉毒杆菌毒素,自1989年上市以来,已经获批用于治疗包括眼睑痉挛和斜视,成人上、下肢痉挛,慢性偏头疼,神经性尿失禁,膀胱过度活动综合征等多种适应症。BOTOX长久而完善的安全性和有效性记录,使得它可以成为儿童患者的一个重要的治疗选择。
2.28亿美元的“牵手”!GENFIT、拓臻生物打造NASH疗法
GENFIT公司宣布,该公司与Terns Pharmaceuticals达成一项研发许可和合作协议。根据协议,Terns将获得GENFIT公司的主打在研产品elafibranor在大中华区的开发和推广权益,治疗非酒精性脂肪性肝炎(NASH)和原发性胆汁性胆管炎(PBC)。
GENFIT公司开发的elafibranor是一款PPARα和PPARδ的双重激动剂。这两种核受体介导多种生理过程,包括脂肪代谢、葡萄糖代谢平衡和炎症等等。这款疗法已经获得FDA授予的突破性疗法认定,用于治疗PBC。它目前在3期临床试验中检验治疗NASH患者的疗效,这一试验预计在今年年末获得结果。
图片来源:GENFIT公司官网
根据研发许可和合作协议,GENFIT将获得3500万美元的前期付款,并且根据潜在临床开发、监管及推广里程碑,可获得1.93亿美元的后续付款。Terns获得elabibranor在大中华地区治疗NASH和PBC的独家开发和推广权益。作为合作的一部分,GENFIT和Terns将在肝病领域开展联合研发项目,包括将elafibranor与Terns公司的在研化合物构成组合疗法。
“诱导”完美腹肌?艾尔建肌肉刺激系统喜获FDA批准
艾尔建(Allergan)宣布,其CoolTone肌肉刺激系统获得FDA批准,用于改善、加强腹部肌肉,实现更结实的腹部。CoolTone还适用于刺激臀部和大腿,帮助这些肌肉的塑形。
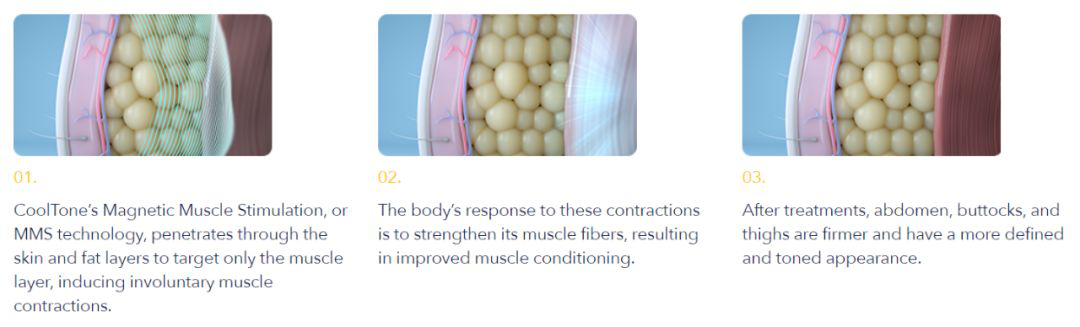
▲CoolTone的作用机理示意图(图片来源:CoolTone官网)
CoolTone使用磁力肌肉刺激(MMS),诱导非自主的肌肉收缩。身体会通过加强肌肉纤维来对这些收缩作出反应,从而改善该区域的肌肉状况。无论是针对腹部、臀部还是大腿,CoolTone都能够让治疗区域的肌肉更为紧密、结实,从而产生更加线条明确和健美的外观。在接触点,CoolTone的磁场强度比其他产品高50%(1.35 T对比0.9 T)。
捷报再传!GSK公司PARP抑制剂获优先审评资格
葛兰素史克(GSK)宣布,FDA接受了该公司旗下的TESARO公司为PARP抑制剂Zejula(niraparib)递交的补充新药申请(sNDA),并且授予其优先审评资格。这一sNDA申请扩展Zejula的适应症范围,治疗接受过3种以上前期疗法的卵巢癌患者。这些患者携带BRCA基因突变;或者具有同源重组缺陷(HRD),并且在接受过最近一次铂基化疗6个月后疾病继续进展。
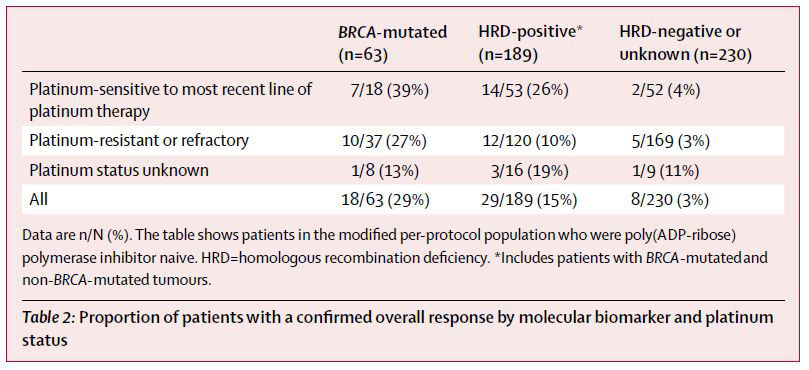
▲QUADRA试验中Zejula在不同类型卵巢癌患者中的表现(图片来源:The Lancet Oncology)
Zejula是GSK去年以51亿美元收购TESARO之后获得的重要PARP抑制剂。PARP抑制剂是利用“合成致死”原理开发的抗癌药物。通过抑制PARP介导的DNA损伤修复机制,在携带BRCA基因突变的肿瘤中导致过度DNA损伤的积累,从而引发细胞死亡。这一sNDA是基于名为QUADRA的开放标签,单臂2期临床试验的结果。在这项试验中,研究人员发现,Zejula不但在携带BRCA基因突变的患者中产生疗效(总缓解率为29%),在不携带BRCA基因突变,但是具备同源重组缺陷的患者中也产生了疗效(总缓解率为15%)。在不携带BRCA基因突变,且不具备同源重组缺陷的患者中,Zejua达到的总缓解率为3%。
向鼻窦炎SAY NO! Dupixent第三项适应症喜获FDA批准
FDA宣布,批准赛诺菲(Sanofi)公司和再生元(Regeneron)公司联合开发的重磅药物Dupixent(dupilumab)扩展适应症,与其他药物联用治疗伴有鼻息肉的慢性鼻窦炎(CRSwNP)成人患者。这是第一款获得FDA批准,治疗症状未得到足够控制的CRSwNP患者的生物制剂疗法。Dupixent目前获得批准治疗三项2型炎症导致的适应症,包括中重度湿疹、中重度哮喘和CRSwNP。

Dupixent是一款抑制IL-4和IL-13信号通路的全人源化单克隆抗体。这两种蛋白在2型炎症中起到关键性作用。Dupixent的临床试验数据显示抑制IL-4和IL-13能够减少2型炎症,它在CARSwNP、哮喘和湿疹中起到重要作用。FDA的批准是基于两项关键性临床试验的结果(SINUS-24和SINUS-52)。在这些试验中,Dupixent达到了所有的主要和次要临床终点。
有志者,事竟成!阿斯利康PD-L1疗法组合达到3期临床终点
阿斯利康(AstraZeneca)公司宣布,该公司开发的PD-L1单克隆抗体Imfinzi(durvalumab),在一线治疗广泛期小细胞肺癌(extensive-stage small cell lung cancer,ES-SCLC)的3期临床试验中,显著提高患者总生存期,达到了试验的主要终点。这款癌症免疫疗法有望继罗氏(Roche)的PD-L1抑制剂Tecentriq之后,成为第二款获批一线治疗SCLC的PD-L1抑制剂。

Imfinzi是一款人源化抗PD-L1单克隆抗体,它通过防止PD-L1与PD-1和CD80受体的结合,解除免疫抑制,增强人体免疫系统对抗癌症的能力。它已经获得批准,治疗经治晚期膀胱癌患者和经治3级(stage 3)无法切除的NSCLC患者。
3.48亿!BridgeBio剑指年度最大生物科技IPO
致力于开发治疗遗传疾病创新疗法的BridgeBio Pharma公司正式登陆纳斯达克(Nasdaq),通过IPO融资高达3.48亿美元,摘得目前为止,今年最大生物技术IPO的桂冠。

BridgeBio拥有多个研发项目,每个研发项目由半自主的分公司进行。它们可以与其他分公司和母公司分享资源。这种构架让BridgeBio能够根据项目的进展和需求,灵活分配资源,提高公司运转效率。目前该公司的研发管线中有16个研发项目,其中3个已经处于3期临床试验阶段。
为了罕见病患者!FDA批准NMOSD首款疗法
美国FDA批准Alexion Pharmaceuticals公司开发的补体抑制剂Soliris(eculizumab)扩展适应症,治疗视神经脊髓炎谱系疾病(NMOSD)患者,这些患者携带抗水通道蛋白4(AQP4)的抗体。这是FDA批准治疗这一自身免疫疾病的首款疗法。

Soliris是Alexion公司开发的一款C5补体抑制剂,通过抑制补体级联反应终端的C5蛋白,降低炎症反应。它已经在多个国家获得批准,用于治疗阵发性夜间血红蛋白尿(PNH)、非典型溶血性尿毒症综合征(aHUS)和抗乙酰胆碱受体抗体阳性的重症肌无力(anti-AchR+ gMG)等与补体有关的罕见病。
挑战DMD!辉瑞公布新基因疗法人体试验早期数据
辉瑞(Pfizer)公司公布了旨在治疗杜兴氏肌营养不良症(Duchenne muscular dystrophy, DMD)的基因疗法PF-06939926,在1b期临床试验中获得的初步结果。试验结果显示,这一基因疗法能够提高患者肌肉中抗肌萎缩蛋白的表达水平,并且改善肌肉功能性指标。
图片来源:辉瑞公司官网
辉瑞公司开发的PF-06939926是一款在研基因疗法。它将由人类肌肉特异性启动子控制的“迷你”抗肌萎缩蛋白(mini-dystrophin)转基因装在腺相关病毒9(AAV9)载体中。AAV9病毒载体具有向肌肉组织靶向递送转基因的能力。这款在研疗法已经被FDA授予孤儿药资格和罕见儿科疾病药物认定(rare pediatric disease designation)。
以一敌五!FDA批准辉瑞贝伐珠单抗生物类似药
辉瑞(Pfizer)宣布,FDA批准了其生物类似药Zirabev(bevacizumab-bvzr)的上市申请。Zirabev是重磅抗癌药物贝伐珠单抗(bevacizumab)的生物类似药,被批准用于治疗五种癌症:转移性结直肠癌;不可切除的局部晚期,复发或转移性非鳞状非小细胞肺癌(NSCLC);复发性胶质母细胞瘤;转移性肾细胞癌(RCC);以及持续性、复发性或转移性宫颈癌。

▲贝伐珠单抗的作用机理(图片来源:Ajnr.org)
作为一款能特异性结合血管内皮生长因子(VEGF)蛋白的单抗,贝伐珠单抗通过阻止VEGF与血管细胞上的受体的结合,来干扰肿瘤的血液供应,抑制它的扩散。本次FDA的批准是基于对Zirabev与贝伐珠单抗的生物类似性的综合数据的审评。数据显示了Zirabev的临床等效性和无差异性。

