7月15日,香港证券交易所最新公告,康宁杰瑞生物制药(下称康宁杰瑞)已提交上市申请,遵循上市规则为第十八A章所定义的生物科技公司。根据招股书,本次赴港上市的主要原因是为关键在研项目的研发和商业化筹集资金:包括PD-L1/CTLA-4双特异性抗体体新药KN046的开发和商业化,适应症包括但不限于鼻咽癌、尿路上皮癌、肝癌、黑素瘤、非小细胞肺癌、三阴乳腺癌及食管鳞状细胞癌等;另外,还将用于HER2双特异性抗体KN026,及重组人CTLA-4变体Fc融合蛋白注射液KN019的临床开发。

▲截图来源:披露易
双特异性抗体:KN046
目前,KN046在中国和澳大利亚处于1期临床试验阶段,近期正在针对多个肿瘤适应症启动2期临床试验。根据康宁杰瑞公告,PD-L1/CTLA-4是针对目前仅有的两个经过临床验证的肿瘤免疫靶点而设计的双特异性抗体,其在临床前和临床中显示了良好的临床疗效和安全性。该产品可以同时阻断PD-L1和CTLA-4两种途径,在肿瘤免疫部分具有协同作用。另有研究表明,通过抑制VEGF可以创造一个有利于PD-L1作用的微环境,因此联合使用PD-L1/CTLA-4双靶点抗体与VEGF抗体具备增强免疫反应的潜力,两者是一个提高抗肿瘤治疗效果的合理组合。

HER2双特异性抗体:KN026
去年10月,康宁杰瑞宣布其自主研发的HER2双特异性抗体(产品代码:KN026)的临床试验申请已获得美国FDA批准,预期不久将启动美国临床试验。同时该产品在获得中国国家药监局颁发的药物临床试验批件后,近日已经顺利完成了第一例病人的给药。KN026是该公司采用具有自主知识产权的Fc异二聚体平台技术(CRIB)开发的HER2双特异性抗体,识别HER2上的两个不同表位。KN026分子的大小和形状与天然IgG抗体相同。KN026采用常规抗体生产工艺,产品得率和质量都达到全球领先水平。

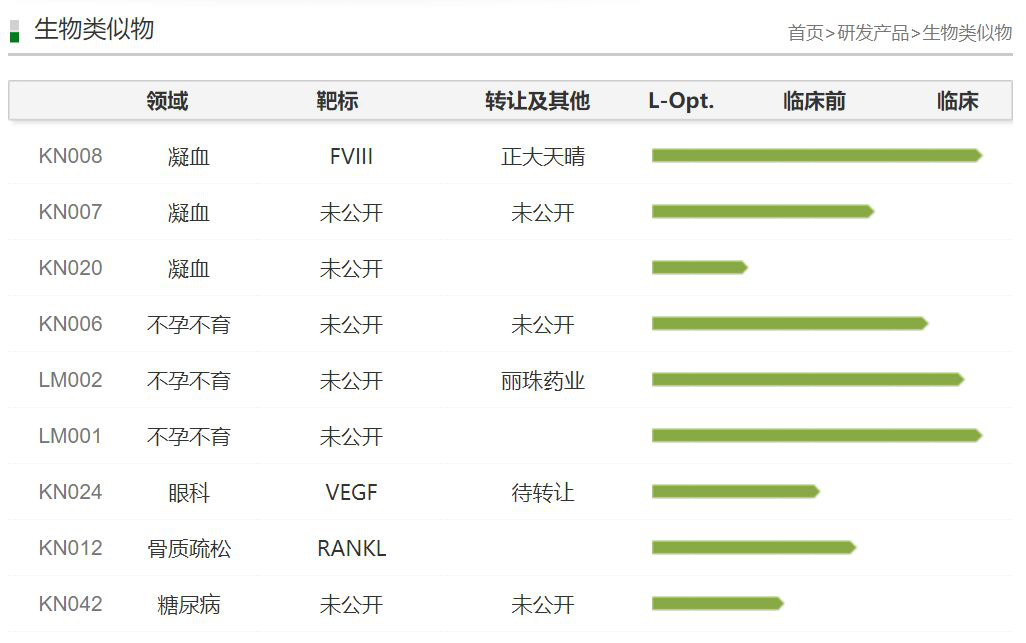
▲康宁杰瑞在研产品线(截图来源:康宁杰瑞官网)
重组人CTLA-4抗体:KN019
KN019是一款重组人CTLA-4变体Fc融合蛋白注射液,作用于CD80/CD86阻止T细胞的激活,用于预防接受肾移植的成年患者器官排异反应,其优越疗效已在临床试验的长期跟踪研究中得到了充分的证实。研究显示,KN019中试生产得率高,蛋白的一级结构、高级结构和翻译后修饰与原研药高度相似,药理毒理研究结果也与原研药高度一致。目前,KN019的1期临床试验已经结束,阶段性临床试验数据表明KN019具有良好的安全性和药代动力学特性,2期临床试验将在20多家医院和机构展开。
PD-L1抗体:KN035
另外,根据康宁杰瑞官网,该公司还自主研发了一款皮下注射PD-L1抗体新药(研发代码KN035),该产品早期开发和临床前研究由康宁杰瑞完成。2016年2月,康宁杰瑞与思路迪达成在全球范围联合开发KN035的合作协议,康宁杰瑞负责临床样品和上市后药品生产,思路迪主导全球注册、临床开发和商业化。
根据康宁杰瑞公告,KN035是目前全球首个进入临床开发的PD-L1单域抗体,与目前已经上市和在研的PD-(L)1抗体相比有明显差异化的优势。KN035具有可皮下注射,常温下稳定等优点,从而提高病人用药依从性,改善肿瘤病人生活品质,对实现将肿瘤作为慢性病长期管理的目标具有重要的价值。目前为止,在美国、日本和中国,先后已有300多病人参与了KN035的临床试验。在中国,KN035已进入临床后期开发阶段,其中针对胆管癌的3期临床试验和MSI-H实体瘤的2期临床试验已经在中国展开。

