1.五款抗肿瘤新药获批临床,来自罗氏、亚盛医药、恒瑞医药、广州必贝特
7月23日,中国国家药监局(NMPA)药品审评中心临床试验默示许可最新公告,5款抗肿瘤新药在列,分别是来自罗氏的注射用polatuzumab vedotin,亚盛医药的APG-115胶囊,恒瑞医药的SHR-1316注射液、注射用SHR-1501,以及广州必贝特的BEBT-109胶囊。
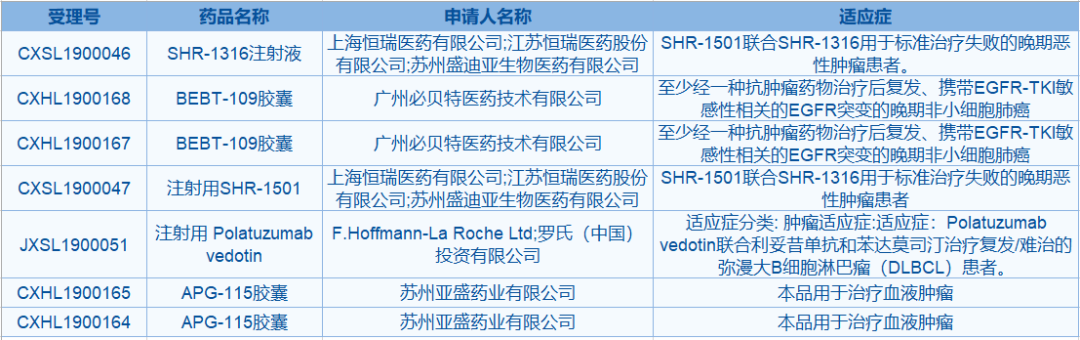
▲资料来源:药物临床试验登记与信息公示平台
Polatuzumab vedotin

Polatuzumab vedotin是一款用于治疗几种类型NHL的同类首款(first-in-class)抗CD79b抗体药物偶联物(ADC)。CD79b蛋白具高度特异性,并在大多数的B细胞NHL中表达,使其成为开发新疗法的潜在标靶。Polatuzumab vedotin与CD79b结合并通过靶向途径破坏这些B细胞,对正常细胞的作用最小化,同时能使肿瘤细胞死亡最大化。今年2月,该药获得FDA授予的优先审评资格,将用于与bendamustine和Rituxan(rituximab)联用,治疗复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)。
APG-115

APG-115是一款抑制MDM2-p53 PPI的口服、选择性小分子抑制剂。p53蛋白在预防癌症形成及发展起重要作用,且p53功能障碍可导致各种癌症。APG-115旨在通过阻断 MDM2-p53 PPI以激活p53肿瘤抑制活性。临床前研究表明,APG-115对MDM2具有高结合亲和力,并能够激活p53。亚盛医药认为,APG-115具有成为同类最优的潜力,可能克服目前在研的其他MDM2-p53抑制剂所遇到的化学稳定性问题。目前,该产品正在中国和美国对腺样囊性癌(ACC)及肉瘤患者进行剂量递增1期临床试验。该公司还在美国针对身患不可切除或转移性黑色素瘤的患者展开APG-115及帕博丽珠单抗注射液的2期联合用药治疗研究。
SHR-1316 & SHR-1501

SHR-1316注射液是恒瑞医药自主研发的一种人源化抗PD-L1单克隆抗体,主要用于恶性肿瘤的治疗。2017年1月,该药获得在美国开展药物临床试验的书面通知。同时,该药已在中国获准开展多项临床试验。目前,SHR-1316正在开展两项临床研究,分别是SHR-1316/安慰剂联合卡铂和依托泊苷治疗广泛期小细胞肺癌3期试验,以及PD-L1抗体SHR-1316在晚期恶性肿瘤患者中的安全性和耐受性的1期研究。根据恒瑞医药公告,SHR-1501为注射用IL-15,有望联合PD-1单抗加强免疫治疗疗效。
BEBT-109

根据广州必贝特官网,BEBT-109是全球首个上市第三代EGFR抑制剂Osimertinib (AZD9291)基础上研发的创新一类新药。具有创新化学结构和全球自主产权,抑制敏感突变型EGFR和T790M突变EGFR活性高,对野生型EGFR抑制选择性大于1000倍。通过改进药代动力学,该产品具有较好的安全性,且在携带EGFR突变的肿瘤模型显示强大抗肿瘤活性,MTD是最小有效剂量的16倍。据悉,该药有望成为best-in-class第三代EGFR抑制剂。
2.基石药业ivosidenib桥接注册性1期试验在中国获批

7月22日,基石药业宣布,NMPA近期批准ivosidenib (TIBSOVO)在中国启动一项桥接注册性1期试验,以治疗携带IDH1基因突变的复发或难治性急性髓系白血病(R/R AML)患者。这是继ivosidenib(TIBSOVO)全球注册3期试验AGILE在中国完成首例患者给药后,该产品在近期取得的又一进展。
AML是成人中常见的急性白血病,且疾病进展迅速。在所有AML病例中,约6%~10%存在IDH1基因突变,造成正常的血液干细胞分化受阻,引发疾病。Ivosidenib是一种强效、高选择性的同类首创IDH1抑制剂,由基石药业的合作伙伴Agios Pharmaceuticals开发,已于2018年7月获得FDA批准,用于治疗经FDA批准的伴随诊断检测的携带易感IDH1基因突变的成人R/R AML。根据公告,该产品是首个也是目前唯一在美国上市的针对携带IDH1基因突变的靶向治疗药物。
3.中国首个国产生物类似药汉利康最新用药数据发布

近日,来自中山大学肿瘤防治中心的淋巴瘤专家蔡清清教授在公开场合发布了目前汉利康在中国1552例患者的用药数据。汉利康是利妥昔单抗生物类似药,主要用于非霍奇金淋巴瘤的治疗。报告显示,其中约80%的患者属于初治患者,由原研药中途转换为使用汉利康的患者比例高达近40%。安全性方面,仅约4%的患者发生输注相关不良反应,且大部分为轻中度;尤其对于转换患者,汉利康的输注反应发生率更低,进一步证实了汉利康在真实世界中的安全性,增强了与会专家使用汉利康的信心。疗效方面,复宏汉霖表示将会继续做好数据随访,第一时间向公众发布。
4.优时比类风关创新药希敏佳在华获批

7月23日,全球性生物制药公司优时比宣布,希敏佳(培塞利珠单抗注射液)已获NMPA批准,用于中重度活动性类风湿关节炎的治疗。作为优时比引入中国的首款生物制剂,希敏佳的获批标志着优时比在中国正式进军免疫系统疾病领域,同时也是优时比在华战略调整的重要里程碑。
此次希敏佳的获批是基于RAPID-C和RAPID-C OLE(RAPID-C开放标签扩增试验)两项3期临床试验,旨在评估培塞利珠单抗注射液的疗效与安全性。为期24周的RAPID-C临床试验结果显示,在既往对甲氨蝶呤(MTX)应答不足的中国类风湿关节炎患者中,培塞利珠单抗注射液联合甲氨蝶呤应答迅速,可持续且显著地缓解症状,有效改善类风湿关节炎体征。在上市申请中,优时比还同时提交了2项首次针对育龄期女性开展的临床试验的结果,该结果展现了培塞利珠单抗注射液对于妊娠期和哺乳期女性的药代动力学优势。
5.《关于建立医疗保障待遇清单管理制度的意见(征求意见稿)》公开征求意见
7月22日,中国国家医疗保障局研究起草了《关于建立医疗保障待遇清单管理制度的意见(征求意见稿)》,目的是促进医疗保障制度的长远可持续发展,公平适度保障人民群众基本医疗保障权益。现向社会公开征求意见,公众可在8月6日前提出意见。

