8月6日,中国国家药监局(NMPA)药品审评中心(CDE)最新公告,7款新药共计9个受理号获得CDE临床试验默示许可。具体如下:
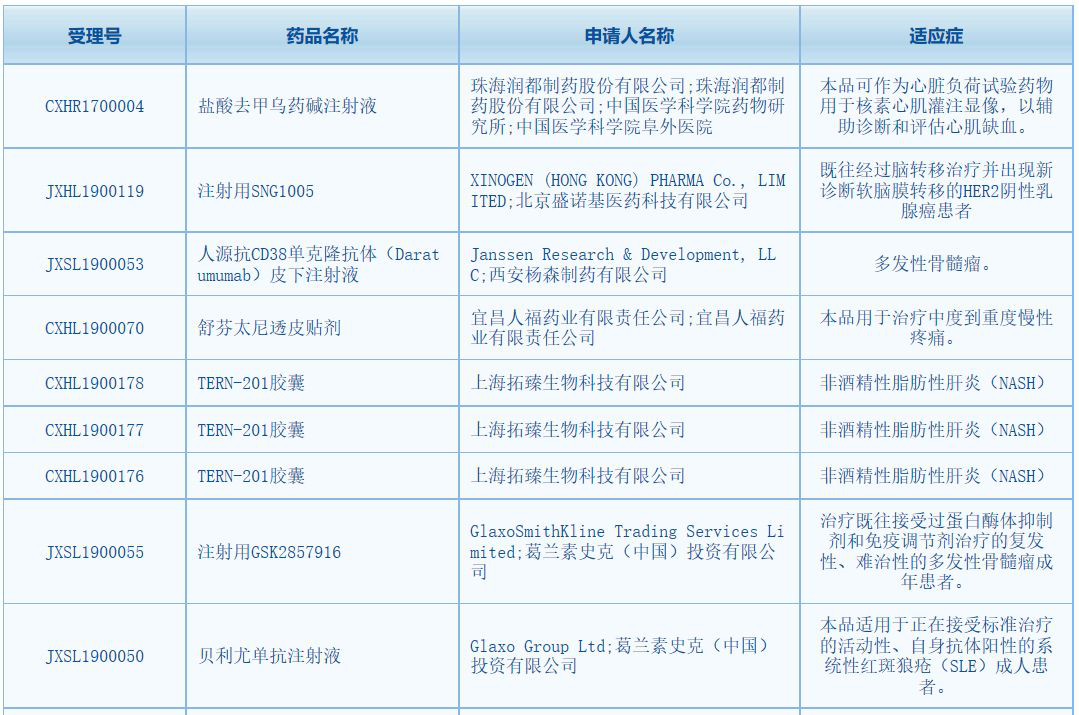
▲截图来源:中国国家药监局药品审评中心官网
同样在上个月,葛兰素史克(GSK)宣布,注射用贝利尤单抗(商品名:倍力腾)获得NMPA上市批准。根据公告,作为全球首个获批应用于治疗系统性红斑狼疮(SLE)的生物制剂,贝利尤单抗此次在中国被批准适应症为系统性红斑狼疮成年患者。贝利尤单抗是一种全人单克隆抗体,静脉给药,能够抑制B细胞的增殖及分化,诱导自身反应性B细胞凋亡,从而减少血清中的自身抗体,达到治疗系统性红斑狼疮的目的。
来自GSK的另一款GSK2857916,则是一种Fc段经加工后的人源化抗BCMA单克隆IgG1抗体和MMAF(一种微管合成抑制剂,细胞毒药物)的耦合物,其与浆细胞结合后可被内吞到细胞内,随后抗体与MMAF之间的耦合被胞内的溶酶体降解,释放出MMAF,直接诱导浆细胞凋亡。目前,该药治疗难治复发性MM的临床研究正在进行中。
TERN-201是一种高效的、高选择性的SSAO抑制剂。今年6月,拓臻生物和Terns Pharmaceuticals在《第九届全国非酒精性脂肪性肝病和酒精性肝病学术会议》进行大会发言,介绍用于治疗非酒精性脂肪性肝炎的SSAO抑制剂TERN-201项目的临床前研究结果,该论文演讲获得优秀论文一等奖。
北京盛诺基申报的SNG1005,是由紫杉醇分子与经特殊设计的氨基酸短肽偶联得到,可与LPR1受体特异性结合,介导紫杉醇进入脑内发挥药效。静脉给药后,除全身治疗作用外,还具有穿透血脑屏障从而控制颅内病灶的独特特点。2.迦瑞生物与大化制药共同开发一款阿尔茨海默病新药在澳门获批上市
8月6日,上海迦瑞生物医药有限公司,一家专注于创新制剂医药研发公司,宣布与大化制药合作研发的Rivamensa透皮贴片近日在澳门获得注册上市许可。该卡巴拉汀透皮贴片是卡巴拉汀药物的一种创新透皮剂型。临床研究显示,卡巴拉汀贴剂可改善阿尔茨海默病(AD)患者的记忆力和维持日常活动能力,贴剂给药组与口服给药组的治疗效果相当,病人依从性较好,超过70%的看护人员认为贴剂优于胶囊,表现为患者比较愿意配合医嘱,对日常生活的干扰也较少。经过制剂优化,Rivamensa较同类产品皮肤刺激性较少,为患者长期使用提供了更好的基础。据统计,中国老年人群AD患病人口已经超过600万,预计到2050年患病人口将超过2000万,是世界上AD患病人口最多、增长速度最快的地区。

8月6日,信达生物宣布与北京盛诺基医药达成一项临床研究合作,将在中国启动评估SNG1005和PD-1抗体信迪利单抗联合用药的临床开发,拟开发的适应症为晚期癌症。SNG1005是盛诺基医药从中国境外引进的紫杉醇分子与氨基酸短肽偶联化合物,在今日获得CDE临床试验默示许可。该产品在美国已完成多个2期临床试验,其3期临床方案已获美国FDA批准,盛诺基医药拥有在大中华区的开发和商业化权利。目前,该产品在中国申请的针对乳腺癌脑转移的2/3期临床试验申请已获得NMPA批准,临床试验正在启动中。信迪利单抗注射液是信达生物与礼来制药合作开发的PD-1抑制剂。2018年12月正式被NMPA批准上市,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。



