中国国家药监局(NMPA)药品审评中心最新公告,2款抗体药物的上市申请拟纳入优先审评。分别是信达生物的利妥昔单抗注射液和百时美施贵宝的纳武利尤单抗注射液。
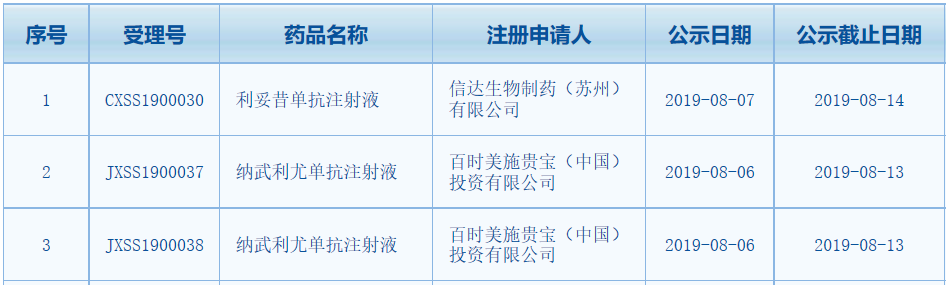
▲截图来源:中国国家药监局(NMPA)药品审评中心官网
利妥昔单抗是一种单克隆抗体,可与B淋巴细胞表面的CD20抗原结合,介导补体依赖性细胞毒作用(CDC)和抗体依赖性细胞介导的细胞毒作用(ADCC),介导体内正常及恶性B细胞溶解,从而实现抗肿瘤治疗效果。今年6月。信达生物与礼来制药共同宣布,双方共同开发的利妥昔单抗注射液生物类似药(IBI301)的新药上市申请已经获得NMPA受理,适应症为非霍奇金淋巴瘤(NHL)。此次该药上市申请,拟按优先审评范围(一)7款重大专项纳入优先审评程序,预计申报适应症为NHL。若获批上市,该药将成为继复宏汉霖的汉利康之后,第二款中国产利妥昔单抗生物类似药。
纳武利尤单抗是由百时美施贵宝开发的PD-1抗体新药。2018年6月,NMPA正式批准纳武利尤单抗用于部分非小细胞肺癌(NSCLC)成人患者。该药由此成为中国批准注册的首个以PD-1为靶点的单抗药物,非小细胞肺癌也是目前为止Opdivo在中国获批的唯一一个适应症。在药物临床试验登记与信息公示平台上,该药登记了超过20项临床试验,适应症包括胃癌、食管癌、胃食管交界处癌、胸膜间皮瘤等。
2.歌礼原研全口服丙肝治愈方案临床研究入选美肝会TOP10%摘要及壁报演讲

8月7日,歌礼宣布其开发的全口服丙肝治愈方案2/3期临床研究摘要已通过第70届美国肝病研究学会(AASLD)年会组委会的评定,入选TOP10%摘要和壁报演讲。该项研究为大型多中心随机双盲安慰剂对照2/3期试验,由中国大陆42家中心共同参与,共纳入424例非肝硬化的GT1 HCV感染初治成人患者。研究证实:应用拉维达韦联合利托那韦强化的达诺瑞韦和利巴韦林治疗12周后,治愈率(SVR12)高达99%,且疗效不受基线NS5A耐药相关替换影响,同时具有良好的耐受性。拉维达韦是歌礼开发的针对NS5A靶点的新一代泛基因型直接抗丙肝病毒药物,与2018年6月初获批上市的歌礼首个抗丙肝1类创新药戈诺卫联合使用,组成中国首个原研12周DAA全口服丙肝治愈方案(RDV/DNV治疗方案)。
3.信达生物信迪利单抗联合IBI305临床研究招募一线晚期肝癌患者

8月7日,信达生物宣布,其正在开展信迪利单抗联合IBI305对比索拉非尼用于晚期肝细胞癌一线治疗有效性和安全性的随机、开放、多中心研究,已得到中国国家药监局(NMPA)药物临床试验批件,计划全国招募566名未接受过针对晚期肝细胞癌的全身系统性抗肿瘤治疗的受试者。信迪利单抗(研发代号:IBI308)是重组全人源抗PD-1单克隆抗体(已上市,商品名:达伯舒);IBI305是重组抗血管内皮生长因子(VEGF)人源化单克隆抗体注射液(已申请上市)。





