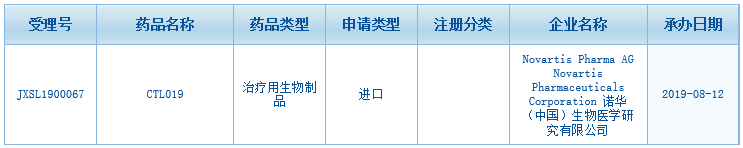
▲图片来源:CDE网站
CTL019是一款需基因改造的自体T细胞免疫疗法,其治疗需先从患者体内提取出T细胞,并在生产中心进行遗传改造。这些T细胞会被引入全新的嵌合抗原受体(CAR),使T细胞有能力直接靶向并杀伤带有CD19抗原的白血病细胞。当这些T细胞改造完成后,被输注回患者体内进行治疗。CTL019曾获得美国FDA颁发的突破性疗法认定,优先审评资格,以及快速通道资格。作为全球首款CAR-T疗法,CTL019可以说是开启了肿瘤免疫治疗的新篇章。

CTL019最早始于宾夕法尼亚大学,诺华于2012年与宾夕法尼亚大学签定全球合作协议,共同研究、开发与商业化包括CTL019在内的多项CAR-T疗法。之后几年,诺华陆续公布了该药的临床数据,证明了其在复发性/难治性急性淋巴细胞白血病(r/r ALL)儿童及年轻成人患者中的疗效和安全性。多年投入和努力,终迎硕果。2017年7月,FDA肿瘤药物专家咨询委员会(ODAC)召开针对诺华CAR-T疗法CTL019的评估会议,最终以10:0的投票结果一致推荐批准该疗法。同年8月,FDA宣布正式批准该疗法上市,用于治疗复发性或难治性儿童、青少年B-细胞急性淋巴细胞白血病,商品名为Kymriah。
此次,CTL019在中国申报临床并获得受理,是该创新疗法在全球进行注册的又一大进展。希望这款创新疗法能够早日造福更多需要的癌症患者。

