
上半年,基石药业在产品管线方面取得的重大进展有:
1.PD-L1抗体(CS1001):于今年4月在中国启动了一项CS1001针对胃癌患者的3期临床试验。于今年6月获批在中国启动CS1001联合fisogatinib(CS3008)用于局部晚期或转移性肝细胞癌患者的临床试验。目前,基石药业正在进行CS1001的5项注册性试验。
CS1001作为一种全人源全长的抗PD-L1单克隆抗体,是一种最接近人体自身天然G型免疫球蛋白4(IgG4)的单抗药物。它可降低在患者体内产生免疫原性及相关毒性的风险,与同类药物相比具有潜在的独特优势。
2.Ivosidenib(CS3010):在中国大陆之外扩展,于今年5月在中国台湾地区提交了TIBSOVO(ivosidenib)的新药申请。于今年7月获得中国国家药监局(NMPA)的批准在中国进行ivosidenib用于IDH1m R/R AML的桥接试验,于同月全球3期AGILE试验中实现首例中国受试者给药。
Ivosidenib是同类首创的强效、高选择性口服突变型异柠檬酸脱氢酶-1(IDH1)抑制剂,已在美国获批用于复发/难治性急性髓系白血病。2018年6月,基石药业与Agios宣布达成独家合作与授权许可协议,推进该药在大中华区的临床开发与商业化。
3.Avapritinib(CS3007):于今年1月获得NMPA的临床试验批准,加入一项比较avapritinib与瑞戈非尼作为不可切除或转移性胃肠道间质瘤(GIST)三线治疗的全球关键性3期研究,并于今年7月实现了首例中国受试者给药。于今年4月获得了NMPA的临床试验批准,开展一项avapritinib用于治疗不可切除或转移性GIST的中国桥接研究。
Avapritinib是一种口服、强效、高选择性的KIT和PDGFRA抑制剂,由基石药业合作伙伴Blueprint Medicines开发。根据公告,大约90%的GIST的发生与KIT或PDGFRA基因突变导致的细胞生长失调有关。已发表过的临床前数据显示,avapritinib在KIT和PDGFRA突变的GIST中显示了强效的抑制作用。目前该药已经在美国针对GIST提交了新药上市申请。
4.Fisogatinib(CS3008):于今年5月在FGFR4抑制剂fisogatinib用于治疗晚期肝细胞癌的全球1期临床研究中实现首例中国受试者给药。
Fisogatinib是一款口服的、高选择性、不可逆的成纤维细胞生长因子受体-4抑制剂,由Blueprint Medicines公司开发,可以极高的特异性抑制FGFR4,从而避免了对FGFR1,FGFR2和FGFR3的作用及因此导致的不良反应。
5.Pralsetinib(CS3009):于今年3月获得NMPA批准启动一项针对RET抑制剂pralsetinib用于RET突变的非小细胞肺癌、甲状腺髓样癌和其它晚期实体瘤在中国1/2期试验的临床试验申请。该研究已于今年8月在中国实现首例受试者给药。
Pralsetinib是一种口服(每日一次)、高效和高选择性的靶向致癌性RET变异的在研药物,由基石药业合作伙伴Blueprint Medicines开发。在临床前研究中,该药针对最常见RET基因融合、激活突变和耐药突变始终表现出次纳摩尔水平的效价。此外,该药对RET的选择性与已批准的多激酶抑制剂相比有显著提高,其中,对RET有效性与VEGFR2相比有超过80倍的提高。
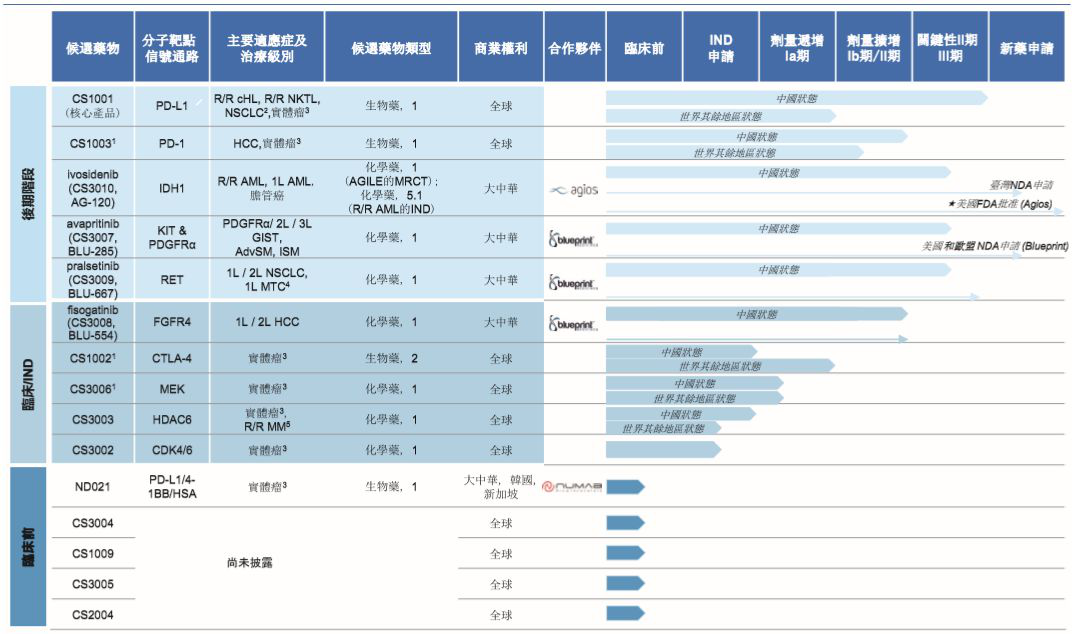
▲基石药业在研管线(截图来源:基石药业中期业绩公告)

