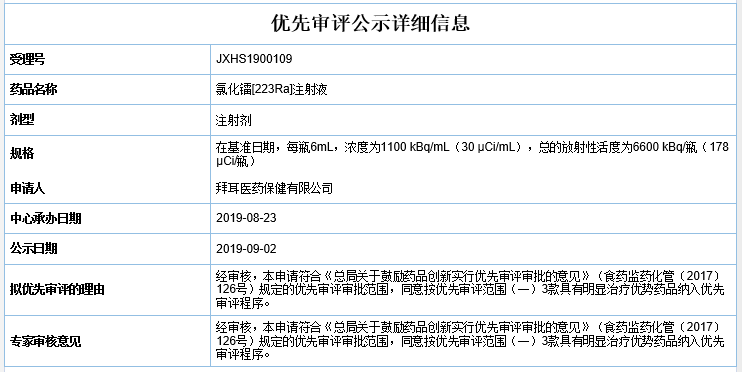
▲拜耳氯化镭[223Ra]注射液拟纳入优先审评理由(来源:CDE官网截图)
氯化镭[223Ra]注射液,英文名为Radium Ra 223 Dichloride,是一种α-粒子辐射放射性治疗药物,它通过发射α粒子作用于骨转移的癌细胞,能够帮助改善患者的生存,且具有良好的安全性。据悉,其活性部分模拟了钙离子,通过与骨骼中的羟基磷灰石(HAP)形成复合物,选择性地靶向骨骼,尤其是骨转移区域。镭233(α-发射器)发射的高LET(线性能量转移)射线,能够在邻近肿瘤细胞中引发高频率的双链DNA断裂,从而产生强效的细胞毒效应。对肿瘤微环境的额外效应,也有助于体内的疗效。

据悉,Xofigo的获批是基于其关键3期ALSYMPCA研究数据。数据表明,该药联合最佳支持治疗(BSoC)相比安慰剂联合BSoC组可使总生存期延长3.6个月(14.9 vs 11.3个月),并使死亡风险降低30%。与安慰剂相比,以 Xofigo 治疗的患者首次出现症状性骨骼事件的时间往后推迟(15.6 vs 9.8个月)。
2013年5月,美国FDA批准了Xofigo上市,用于治疗有骨转移症状但无已知内脏转移的去势抵抗性前列腺癌(CRPC)患者,该药成为全球首款获批的α-粒子放射性治疗药物。前列腺癌是男性中第二大最常见恶性肿瘤,其中CRPC是前列腺癌治疗的难点和重点。骨骼是体内转移性癌症影响的最常见部位,前列腺癌的骨转移尤其普遍。公开数据显示,转移性前列腺癌中有约90%的患者发生骨转移。骨转移已被证明是CRPC患者发病和致死的主要病因。
目前,该疗法已在全球40多个国家批准。有数据显示,2017年Xofigo的全球销售额达到4.08亿欧元。目前拜耳也正在继续推进Xofigo治疗其他癌症的临床研究。

在中国,拜耳于2018年11月向中国国家药监局递交了该药的上市申请(受理号为JXHS1800063),并进入优先审评。根据CDE相关公示可知,拜耳于今年8月再次递交上市申请(受理号为JXHS1900109),并于今日公示拟纳入优先审评。此外,根据中国Chinadrugtrials网站信息,该药用于乳腺癌适应症的临床研究正在进行中。
祝贺拜耳这款抗癌疗法的上市申请拟纳入优先审评,这有望加快该药在中国的上市速度,期待该疗法为需要的患者带来更好的治疗选择。

