当各种创新疗法取得突破的喜讯每天充斥在我们耳边时,肿瘤免疫时代的高光时刻也随之来临,有着多种副作用的化疗似乎成为了过去式。事实上,化疗仍然是当下极其重要的系统性抗癌方法,这其中,鼎鼎有名的紫杉醇就是应用最为广泛的化疗药物之一。这是一种从红豆杉中提取的天然抗肿瘤药物,1992年在美国首次获批用于卵巢癌,商品名为泰素(Taxol)。
现在,距离紫杉醇药物的诞生已过去足足26年,但针对这个药的临床研究却仍在进行。据科睿唯安数据,全球处于研发活跃状态的紫杉醇药物多达80个,包括50余款处于早期开发阶段的产品。在中国,也有55项紫杉醇临床试验正在进行中。就在昨日,海和生物宣布其紫杉醇口服溶液RMX3001的乳腺癌3期临床试验完成中国首例患者给药。
肿瘤免疫疗法时代,老药紫杉醇凭什么还能受到科学界和医学界如此重视?这背后自然离不开这款药为患者带来的临床获益,以及至少在目前尚未有新疗法能够取代其临床地位。今天,我们就来看看紫杉醇在肿瘤界的不老传奇背后,都有哪些让人津津乐道的故事。
最早,紫杉醇是由美国化学家从太平洋紫杉树皮中提取出的一种编号为K172的物质。1967年,该物质的细胞毒性和抗肿瘤活性研究结果首次向社会展示。4年后,化学家采用X射线衍射和核磁共振分析,确定了紫杉醇的结构,这一重磅研究被发表在化学领域顶级期刊《美国化学会杂志》。
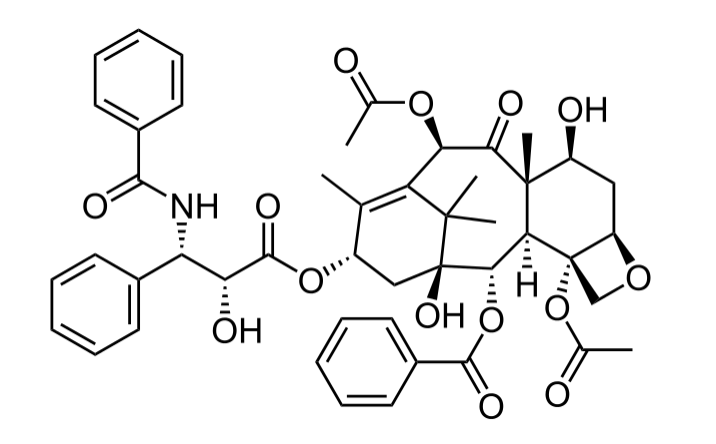
由于当时紫杉醇从植物中提取的有效率只有0.004%,通过砍伐树木提取紫杉醇并非可持续的做法。在之后长达17年的时间里,紫杉醇的临床研究和化学合成研究几乎同时进行。直到1991年,百时美施贵宝(BMS)与美国国家癌症研究所(NCI)达成合作,紫杉醇才真正开启从实验室走向临床应用的商业化之路。
在1992年被美国FDA获批用于卵巢癌之后,BMS继续围绕紫杉醇开展了大量研究,以探索其对乳腺癌、黑色素瘤、非小细胞肺癌(NSCLC)等癌症的治疗效果。经过BMS近10年的努力,这款新药陆续斩获多项适应症,包括三种癌症的一线治疗。
1997年,紫杉醇与顺铂联用被FDA批准用于晚期卵巢癌一线治疗,两者联合用药的有效反应率可达47%。1998年,这一组合被批准用于NSCLC一线治疗,有效率达25%~62%。1999年,紫杉醇与赫赛汀(曲妥珠单抗)联用被批准用于HER2阳性的转移性乳腺癌一线治疗,3期数据显示,该组合可将患者总生存期(OS)从17.9个月延长至24.8个月。
在中国,紫杉醇还被批准用于对于头颈癌、食管癌、精原细胞瘤、复发非何金氏淋巴瘤等癌症患者。数据显示,目前中国已有95家企业共计268款紫杉醇获得注册批准文号。同时,还有不同品种的紫杉醇正在申报中,包括注射用紫杉醇(白蛋白结合型)、紫杉醇微乳注射液、紫杉醇脂质体注射液、紫杉醇脂质微球注射液、以及注射用紫杉醇聚合物胶束等。
之所以在紫杉醇上市后仍有如此多品种在研发和申报,与该产品在临床运用中的缺陷有关。用聚氧乙烯蓖麻油作为有机溶剂的紫杉醇,极易引起机体释放组胺,从而让患者发生过敏。因此,患者在用药之前通常需要经过皮质激素及抗组胺药的预处理,同时紫杉醇一次注射用药需长达3小时。这些问题都限制了该药的临床应用,这也给了后继者不断改进的空间。
白蛋白紫杉醇正是紫杉醇的一个升级版。这是一种用纳米尺度的白蛋白来结合紫杉醇,而生产出的新型药物。由于利用了人源白蛋白作为载体,可直接给药,而无需用药前皮质激素和抗组胺药的预处理,白蛋白紫杉醇的诞生给患者带来了更好的体验。
2005年,白蛋白紫杉醇首次被美国FDA批准用于乳腺癌治疗,商品名为Abraxane。此后,该药还获批用于转移性乳腺癌的二线治疗,非小细胞肺癌的一线治疗(与卡铂联用),以及晚期胰腺癌一线治疗(与吉西他滨联用)。近年来,该药还陆续收获了头颈鳞状细胞癌、泌尿上皮癌和转移性胃食管癌等适应症。
▲紫杉醇(白蛋白结合型)(图片来源:石药集团官网)
值得注意的是,在针对胰腺癌的临床试验中,白蛋白紫杉醇联合吉西他滨组患者总生存期达8.5个月,比吉西他滨单用的6.7个月有明显延长,在无进展生存期和客观缓解率方面也有所提高。
2009年,该药在中国获批用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌。目前,中国有新基(Celgene)、恒瑞医药、石药集团中诺药业三家企业的白蛋白紫杉醇获批上市。其中,新基是白蛋白紫杉醇的原研产家,2017年百济神州从新基手中获得了该药物在中国的独家授权。
来自绿叶制药的紫杉醇脂质体——力扑素,也是紫杉醇升级后的一款创新药物。该药由绿叶制药自主研发,运用脂质体与靶向给药技术,用于非小细胞肺癌、乳腺癌、卵巢癌等癌症的治疗。在2019年《CSCO原发性肺癌诊疗指南》中,力扑素作为一线药物获得CSCO最新指南推荐。
根据绿叶制药公告,力扑素是全球唯一上市的紫杉醇脂质体制剂。该药物将难溶于水的紫杉醇包封在脂质体双分子层中,不再使用易引起严重过敏反应的聚氧乙基代蓖麻油与无水乙醇混合溶媒,在保持紫杉醇特有疗效的前提下,提高了紫杉醇临床使用的安全性,并减少不良反应。
由于其确切的疗效与更好的安全性,上市15年来力扑素已在临床实践中获得医生和患者的广泛认可。目前,该药获批适应症有:卵巢癌一线治疗,与顺铂联合用于不能手术或放疗的非小细胞肺癌患者的一线治疗,以及曾用过含阿霉素标准化疗的乳腺癌患者的后续治疗或复发患者的治疗。
文章开头提到的紫杉醇口服溶液(商品名Liporaxel),则是全球第一个开发成功并获批上市的口服紫杉醇产品。该产品是由大化制药基于其创新的脂质自乳化药物递送技术开发而成的紫杉醇口服制剂。2016年该药成功获得韩国药监机构(MFDS)的上市批准,针对适应症为胃癌。▲紫杉醇口服液Liporaxel(图片来源:海和药业官微)
研究显示,Liporaxel基于独特的创新工艺技术,通过胃肠道吸收,减少用药前处理及外周神经病变等副作用。2017年,海和生物从大化制药获得该产品的中国大陆、台湾、香港及泰国权益。目前,该药已在中国大陆开展3期临床。
另一款即将上市的紫杉醇口服疗法,则是来自生物医药公司Athenex。今年8月,该公司宣布其紫杉醇与encequidar结合的口服配方,在治疗转移性乳腺癌的关键性3期临床研究中达到了主要终点,其疗效显著优于传统静脉注射紫杉醇。

▲Encequidar作用机理(图片来源:Athenex公司官网)
Encequidar是一种新型P-糖蛋白(P-gp)抑制剂。它的特点是不会被吸收,因此可以局部抑制肠道中P-gp的活性,却不会与身体其它部位的P-gp相互作用。在提高药物吸收的同时,减少对身体其它部位的副作用。3期试验显示,与静脉注射紫杉醇相比,这款口服紫杉醇的ORR得到改善(36%),并降低了其神经病变的发生率。
最早被开发并获批上市的紫杉醇胶束来自韩国Samyang公司的Cynviloq,2007年首次在韩国上市用于乳腺癌及NSCLC。据了解,这款药物采用化学高分子材料mPEG-PDLLA,大大降低了微生物污染和免疫抵抗的风险,具有更高的耐受剂量。从一项Cynviloq与Abraxane的关键性BE试验结果来看,两款药物达到生物等效和安全性一致。
去年底,欧盟委员会(EC)也批准了一款紫杉醇胶束(商品名Apealea)联合卡铂用于首次复发的铂敏感性上皮性卵巢癌、原发性腹膜癌、输卵管癌成人患者的治疗。该药结合了Oasmia公司专有的赋形剂XR17,后者是一种基于维生素A的物质,可形成20-60纳米大小的胶束。Apealea由冻干粉组成,溶于常规溶液进行输液,使用起来非常方便。
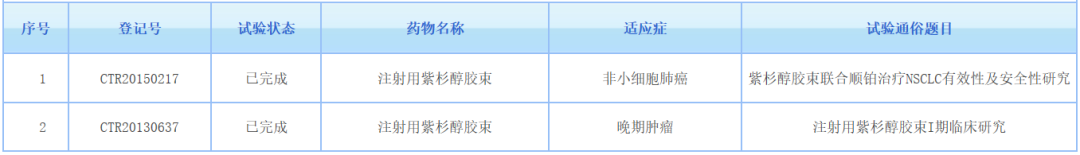
▲紫杉醇胶束临床试验登记情况(截图来源:药物临床试验登记与信息公示平台)
在中国,也有两项紫杉醇胶束的临床试验登记并已完成,均由上海谊众生物申报。其中一项为紫杉醇胶束联合顺铂与普通紫杉醇联合顺铂一线治疗晚期非小细胞肺癌的随机、对照、开放、多中心临床试验。去年5月,海正药业旗下注射用紫杉醇胶束在中国获批临床,拟用于晚期乳腺癌、非小细胞肺癌、胃癌等的治疗。
如今,仍然有很多科学家和制药企业置身于紫杉醇的开发中,究其原因,无外乎瞄准了临床未竟需求。从临床需求出发,一款药物无论如何升级打造,终究要回归到临床需求。紫杉醇的开发之路,正是每一款成功的药物背后不变的真理。正如默克公司创始人乔治•默克先生所说:“药物是为人类而生产,不是为追求利润而制造的。只要我们坚守这一信念,利润必将随之而来。”











