9月10日,中国国家药监局(NMPA)药品审评中心(CDE)最新公布,4款抗肿瘤新药获得CDE临床试验默示许可。具体如下:
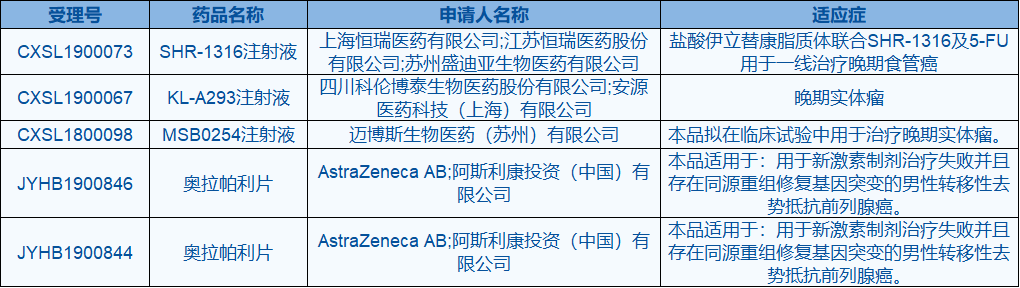
▲临床试验默示许可最新公布(资料来源:CDE官网)
一款“first-in-class”PARP抑制剂,于2014年12月首次被FDA批准,用于治疗携带BRCA种系基因突变的晚期卵巢癌患者,成为全球首个获批的PARP抑制剂。2018年8月,该药在中国获批上市用于治疗卵巢癌,成为中国首款小分子靶向PARP抑制剂。目前,奥拉帕利在美获批适应症有卵巢癌、输卵管癌、腹膜癌、乳腺癌。

今年8月,默沙东(MSD)和阿斯利康(AstraZeneca)宣布,奥拉帕利在治疗转移性去势抵抗前列腺癌(mCRPC)男性患者的3期临床试验PROfound中取得积极结果。数据显示,在携带BRCA1/2或ATM基因突变(HRR基因突变亚群)的mCRPC男性患者中,奥拉帕利与enzalutamide或阿比特龙相比,主要终点放射学无进展生存期(rPFS) 显示统计学显著和有临床意义的改善。据悉,这是目前PARP抑制剂治疗转移性去势抵抗性前列腺癌的唯一一项获得积极结果的3期试验。
江苏恒瑞医药自主研发的PD-L1单抗药物,可以解除PD-L1介导的免疫抑制效应,增强杀伤性T细胞的功能,发挥调动机体免疫系统清除体内肿瘤细胞的作用。2018年11月,恒瑞医药启动SHR-1316针对广泛期小细胞肺癌的临床3期研究,并已在吉林省肿瘤医院及中国医学科学院肿瘤医院开始患者招募。值得注意的是,目前中国尚未有PD-L1产品获批上市。

就在昨日,恒瑞医药公布PD-L1单抗SHR-1316和另一款单抗SHR-1704联合用药的临床试验申请获得NMPA批准,将于近期开展临床研究。此次恒瑞医药获得临床试验默示许可的为:盐酸伊立替康脂质体联合SHR-1316及5-FU用于一线治疗晚期食管癌。目前,这款PD-L1正在澳大利亚、美国和中国三地开展多项试验,适应症包括小细胞肺癌、广泛期小细胞肺癌及晚期恶性肿瘤。
一种新型的人源化抗VEGFR2抗体,通过阻断VEGF-A和VEGF-C介导的肿瘤相关血管生成,抑制肿瘤细胞生长和转移。目前,同类VEGFR2阻断抗体已被FDA批准用于二线治疗胃癌、非小细胞肺癌和结直肠癌,同时该药也有望让肝癌患者获益。根据迈博斯公告,MSB0254将开发上述几个适应症,并作为PD-1/PD-L1抑制剂的重要联合用药,如迈博斯旗下PD-L1抗体MSB2311。

一款抗肿瘤新药,此次获批临床适应症为晚期实体瘤,目前暂无更多信息。根据科伦药业公告,2019年上半年该公司获批7个新产品,正在开展15项创新药的临床研究。其中,KL-A167进入关键临床2期,适应症包括复发或难治性鼻咽癌、复发或难治性经典型霍奇金淋巴瘤;KL-A166注射液在中、美同步进行1期临床试验,适应症尚未可知;另有乙肝用药KL060332正在申请开展临床研究。







