
Tenapanor因作用机理新颖而备受关注。它是一款在胃肠道局部抑制钠/氢交换蛋白3(NHE3)的小分子。NHE3在小肠和结肠表面表达,主要负责吸收食物中的钠离子。该药能通过抑制NHE3的功能,减少钠离子在小肠和结肠的吸收,导致水份向肠道内分泌,从而加快肠道蠕动并导致粪便疏松,从而降低IBS-C患者腹痛。而且它几乎不被人体吸收,因此降低了可能在人体其它部位抑制NHE3活性,造成毒副作用的可能。
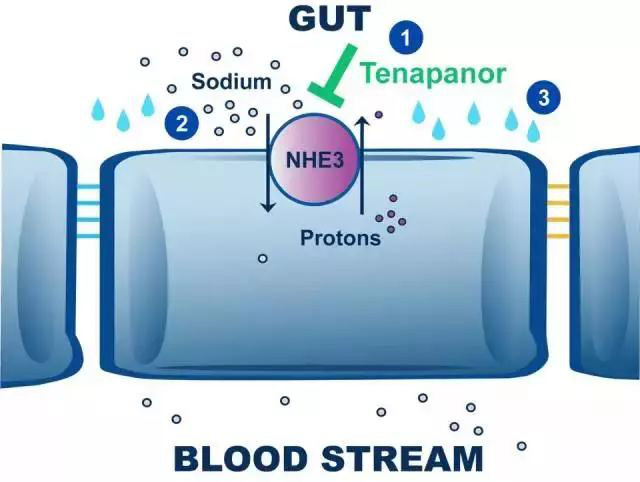
▲Tenapanor的作用机理(图片来源:Ardelyx官方网站)
便秘型肠易激综合征不容小觑。这是一种胃肠道疾病,由于便秘造成的腹痛显著影响患者的健康和生活质量。2015年American Journal of Gastroenterology发表的一项研究表明,50%的IBS-C患者将他们的症状评价为“非常令人困扰”。
Tenapanor在美国获批,是基于两项3期试验的结果,与安慰剂组相比,该药达到了试验的主要终点。在第一项临床试验中治疗组达到缓解的患者比例为37%,对照组为24%,在第二项临床试验中,治疗组的数值为27%,对照组为19%。
过去,FDA已经批准的治疗方法多通过在胃肠道中分泌氯来缓解便秘,但仅能改善部分患者症状。Tenapanor顺利获批,成为首款通过降低肠道钠摄入量来起作用的药物。
早在2017年12月,复星医药就与Ardelyx达成合作,获得该药物在中国独家开发和商业化权益。Ardelyx是一家专注于胃肠道疾病和心肾疾病领域的生物医药公司。根据复星医药早前公告可知,该许可费用为3000万美元,商业化后复星医药还将根据产品销售额支付对方至多9500万美元的销售里程碑款项,及14%~20%的销售提成。
根据复星医药早前公告,目前该公司针对该新药累计研发投入为人民币约7768万元。复星医药在中国的临床申报,正在加速这款创新药在中国的研究进程,希望这款药物能够早日惠及更多患者。

