9月17日,君实生物发布公告,该公司就建议A股于科创板上市通过上海证监局辅导验收。根据中金公司关于上海君实生物医药科技股份有限公司辅导工作总结报告,截至目前,辅导工作已取得良好效果,达到了辅导计划的目标要求。去年底,君实生物已在2018年底成功在香港联合交易所主板上市,成为中国大陆首家“新三板+H”挂牌落地的生物医药企业。若进展顺利,该公司有望成为中国首家“新三板+H+科创板”的生物医药公司。同日,君实生物还宣布,PD-1抗体新药特瑞普利单抗(商品名:拓益)单药治疗经标准治疗失败后的晚期局部进展或转移性膀胱尿路上皮癌患者的关键注册临床研究(POLARIS-03研究)完成最后一例患者入组。这是一项2期、开放标签、多中心、注册临床研究。

早在今年5月,君实生物已在股东周年大会上,获批准拟发行不超过8713万股的该公司A股以及向上海证券交易所申请A股在上海证券交易所科创板上市并准许买卖及相关事宜。
根据君实生物公布的2019年上半年业绩公告,截至2019年6月30日,该公司实现销售收入总额3.09亿元。其中,核心产品拓益实现销售收入3.08亿元;销售及分销开支1.11亿元;研发开支3.69亿元,同比增加69%。
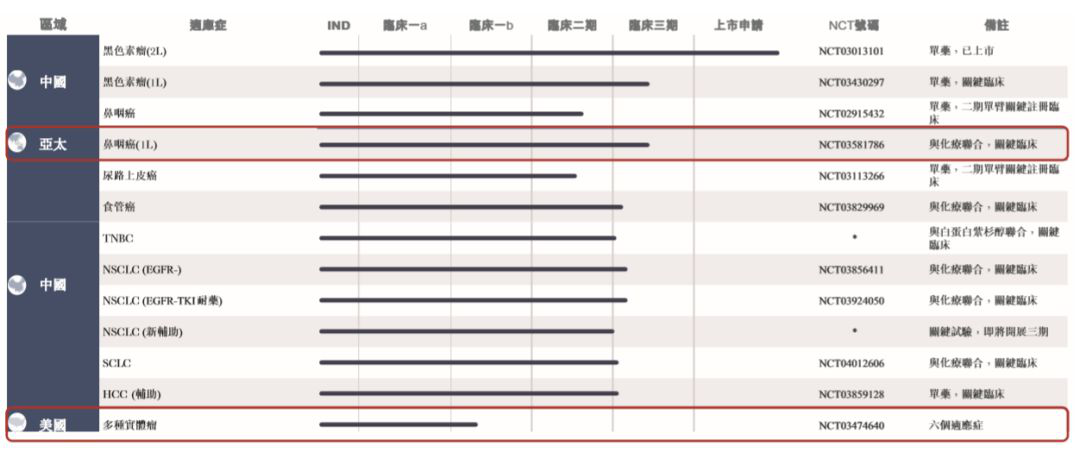
拓益(特瑞普利单抗)在今年2月底实现全国销售,报告期内,拓益销售收入占全部收入99.69%,达到3.08亿。与此同时,君实生物仍在继续验证该药在治疗不同瘤种方面的安全有效性,扩大受益患者人群。截至6月30日,该公司已开展11项临床试验(2期或3期),包括鼻咽癌、尿路上皮癌、黑色素瘤、非小细胞肺癌、三阴性乳腺癌、食管癌及肝细胞癌等。事实上,君实生物构建了丰富的产品管线,覆盖了肿瘤免疫、自身免疫、神经性疾病、代谢、炎症等多个领域。共有19个在研产品,包括13款自主研发的原创新药和6款合作开发新药。其中,8款产品已在中国获得临床试验批准。根据公告,该公司将加快药物研发及药品商业化,包括JS001(特瑞普利单抗)在多肿瘤适应症方面的中国试验及JS001在美国及其他国家的多中心临床试验,重点在于首创药的IND申请及临床试验。

UBP1211:TNF-α靶点单抗药物,君实生物首款生物类似药,即将在中国提交NDA。
JS002:在中国获批临床的抗PCSK9单克隆抗体,目前正在高脂血症患者中进行2期临床试验,同时在更广泛的患者群体中进行3期临床研究的准备工作已启动。
JS004/TAB004:抗BTLA阻断抗体,拟用于治疗晚期不可切除或转移性实体瘤。今年4月,该产品获得美国FDA临床试验批准。
JS005:IL-17A单抗,具有多效性的细胞因子,可用于缓解自身免疫性疾病,如银屑病、类风湿性关节炎、强直性脊柱炎等疾病的症状。目前已在中国获批临床。
此外,君实生物将继续扩大产品管线,在小分子领域进行新药靶点的探索及研发并促进与优秀的小分子药品公司的合作,同时推进对适用于大分子药物的潜在靶点的跟踪及探索研究。在生产方面,该公司计划进一步提高大分子药物的发酵产能并寻求更先进的生产技术以降低成本及满足市场需求。值得一提的是,今年上半年君实生物已投资近4.4亿元用于建设临港生产基地,以大幅提升该公司现有产能。





