9月19日,礼来制药(Lilly)宣布,MONARCH plus预先计划的期中分析数据显示,该研究达到了其主要研究终点。即在以中国患者为主的HR+/HER2-绝经后晚期乳腺癌女性中,证实CDK4/6抑制剂abemaciclib联合芳香酶抑制剂显示出明显的无进展生存期的延长。根据公告,这一研究结果将用来支持abemaciclib在中国的注册申请。
乳腺癌是世界上女性中最常见的癌症类型,大约200万名患者在2018年确诊患有乳腺癌。晚期乳腺癌患者包括转移性乳腺癌患者和局部晚期乳腺癌患者。与早期乳腺癌患者相比,晚期乳腺癌患者的生存率更低,局部晚期患者5年生存率为85%,而转移性乳腺癌患者的5年生存率只有27%。
Abemaciclib是一款CDK4/6抑制剂。CDK4/6通过与D-细胞周期蛋白(cyclin)结合被激活。在雌激素受体阳性乳腺癌细胞系中,细胞周期蛋白D1和CDK4/6能够促进视网膜母细胞瘤蛋白(Rb)的磷酸化,以及细胞周期进展和细胞增殖。
▲Abemaciclib的分子式(图片来源:维基百科)
MONARCH plus是一项在以中国患者为主的HR+/HER2-绝经后晚期乳腺癌女性中进行的随机、双盲、3期临床研究,用以支持abemaciclib在中国的注册申请。研究入组了306名患者接受细胞周期蛋白依赖性激酶CDK4/6抑制剂abemaciclib或安慰剂联合芳香酶抑制剂(来曲唑或阿那曲唑)作为初始内分泌治疗(队列A)及157名内分泌治疗后进展的患者接受abemaciclib或安慰剂联合氟维司群治疗(队列B)。
研究显示,该研究达到了其主要研究终点即在以中国患者为主的HR+/HER2-绝经后晚期乳腺癌女性中证实abemaciclib联合芳香酶抑制剂(阿那曲唑或来曲唑)显示出具有显著统计学意义的无进展生存期的延长。关键次要研究终点即内分泌治疗后疾病进展的女性患者接受abemaciclib联合氟维司群治疗的无进展生存期亦获得显著延长。Abemaciclib联合芳香酶抑制剂(阿那曲唑或来曲唑)或氟维司群耐受性良好,且其安全谱与abemaciclib既往研究结果一致。
基于这一研究的积极结果,礼来中国高级副总裁、药物发展与医学事务中心负责人王莉博士说道:“Abemaciclib是第一个、同时也是目前唯一的在以中国患者为主的3期临床研究被证实有显著无进展生存期获益的CDK4/6抑制剂。这些研究结果进一步夯实了abemaciclib在HR+/HER2-晚期乳腺癌的治疗地位。”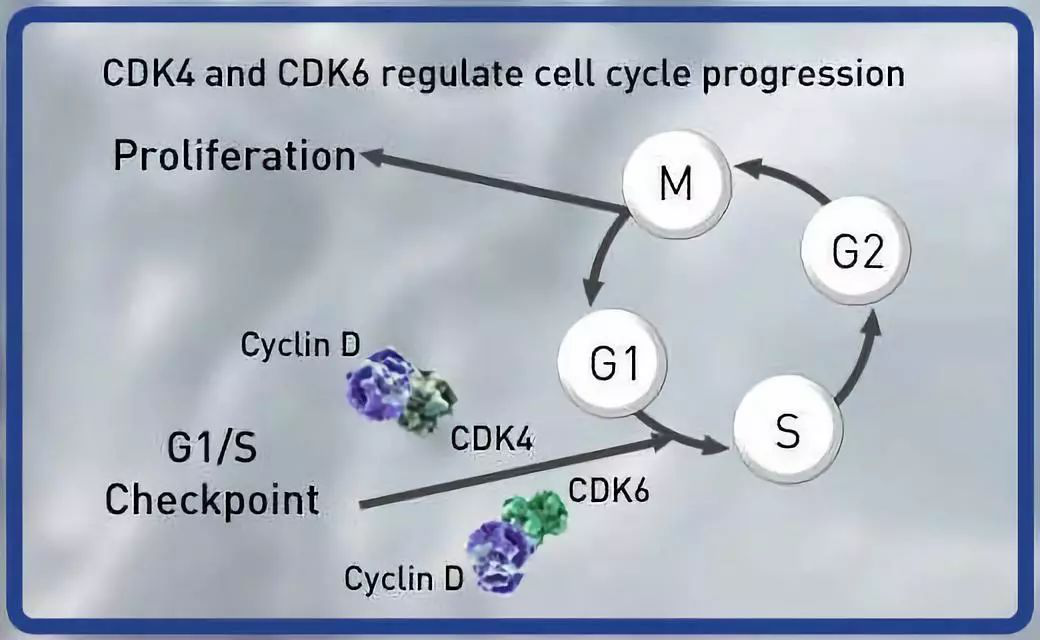
▲CDK4/6调节细胞增殖(图片来源:礼来官网)
2018年3月,礼来宣布美国FDA批准abemaciclib与芳香酶抑制剂构成的组合疗法作为初始疗法治疗患有HR+/HER2-的晚期或转移性乳腺癌的绝经期患者。此前,该药获得批准的适应症患者均为在接受过内分泌疗法之后症状继续恶化的乳腺癌患者。FDA批准abemaciclib作为初始内分泌疗法将大幅度扩展适用于接受这一药物治疗的患者群。
目前,abemaciclib在中国已登记开展了4项研究,其中针对早期乳腺癌、乳腺癌和非小细胞肺癌的研究已进展至3期。MONARCH plus研究的积极结果,将支持礼来在中国提交该药用于乳腺癌初始内分泌治疗的上市申请。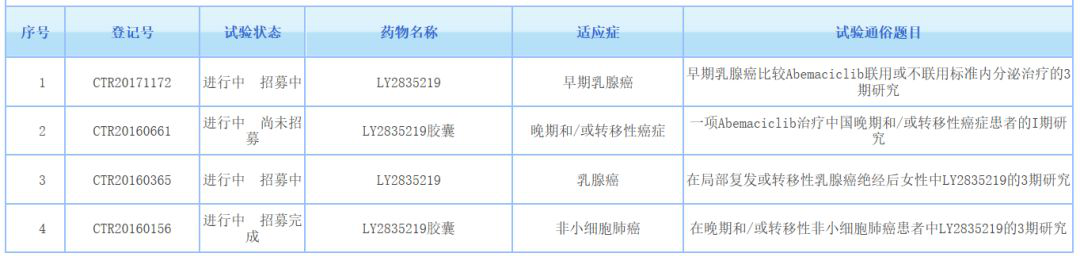
▲Abemaciclib中国临床试验一览(图片来源:药物临床试验登记与信息公示平台)期待这款新药早日在中国获批上市,从而惠及更多患者。




