9月20日,2019 CSCO大会正在厦门火热召开。来自全国各地的近3万名参会者共同参加了此次大会,其中包括600余位来自全球的演讲嘉宾和论文汇报者,以及275家企业。会场上,各大会议厅展示着各种新药在不同癌种中的最新研究结果,其中免疫治疗是当之无愧的大会主角。今天,我们将梳理大会上已经公布的一些亮点。
此次在CSCO上公布的是CheckMate-331研究中国队列数据,这是一项开放、随机的3期临床,主要针对一线铂类化疗后复发或疾病进展的小细胞肺癌(SCLC)患者。研究共纳入中国患者82例,其中进入PD-1抑制剂纳武单抗(Opdivo)组的有39例,进入化疗组(拓扑替康/氨柔比星)的有43例。研究主要终点为治疗12个月后的总体生存率(OS),次要终点是无进展生存期(PFS)以及客观缓解率(ORR)。
去年10月,百时美施贵宝(BMS)宣布CheckMate-331失败,试验未达到主要终点。不过在中国队列研究中,纳武单抗展现了不一样的结果。数据显示,中国队列患者使用纳武单抗后疾病进展的比例为72%,低于全球队列的80%,而两组继续接受治疗的患者比例相当。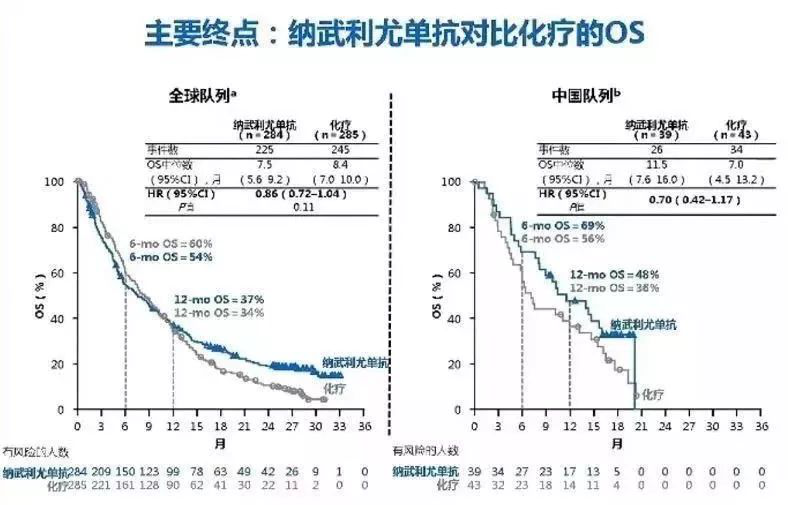
在主要研究终点OS方面,中国队列纳武单抗治疗组中位OS为11.5个月,相比化疗组的7.0个月有显著延长。而这一数据在全球队列则并无改善,纳武单抗组对比化疗组为7.5个月 vs 8.4个月。同时,OS亚组分析显示,无论患者是否铂敏感还是铂耐药,基线LDH表达水平高低,诊断时为广泛期还是局限期,都可以从纳武单抗治疗中获益。
在次要研究终点ORR方面,中国队列纳武单抗治疗组ORR为20.6%,显著高于化疗组的4.7%!而这一数据在全球队列中并不如人意,纳武单抗组对比化疗组为13.7% vs 16.5%。在PFS方面,中国队列和全球队列相似,纳武单抗组中位无进展生存期低于化疗组。
在安全性方面,在纳武单抗治疗期间,并未发现新的安全性信号。无论是中国队列还是全球队列,纳武单抗治疗的患者出现不良反应的概率均低于化疗。不过使用纳武单抗治疗在中国患者身上的不良反应对比整体人群要高,ADR主要出现在肝脏、皮肤和肺部。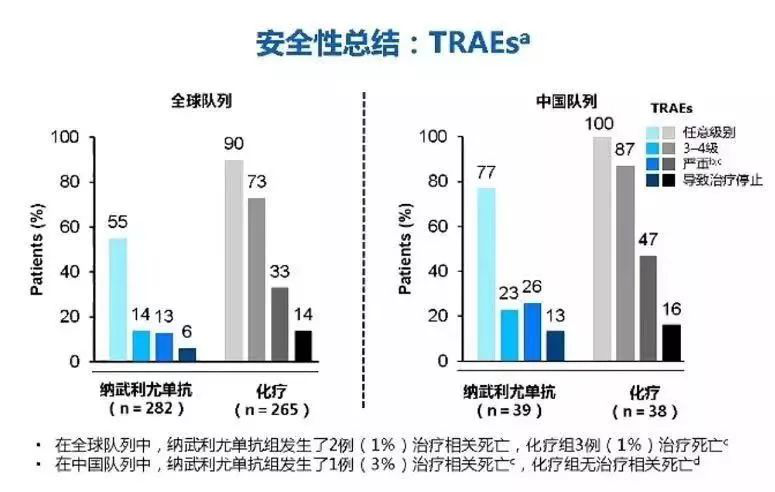
CheckMate-331中国队列的数据显示,纳武单抗治疗小细胞肺癌患者的中位总生存期比化疗有所延长,客观缓解率同样优于化疗。不过,由于中国队列只是代表全球研究的一个小亚组,同时在拓扑替康药物暴露和若干基线特征方面,中国与全球队列有所差异。因此,在解释此次描述性分析结果时应谨慎。
客观缓解率77.8%,基石药业PD-L1抗体一线治疗食管鳞癌
此次在CSCO年会上公布的是一项关于基石药业PD-L1抗体CS1001联合顺铂和氟尿嘧啶(CF)治疗食管鳞癌(ESCC)患者的1b期临床试验初步结果。该队列研究针对晚期食管鳞癌患者,且既往未接受过针对局部晚期或转移性疾病的系统性抗肿瘤治疗。截至2019年7月1日,共有23例患者入组食管鳞癌队列,他们接受CS1001 1200mg每三周一次直到疾病进展或不可耐受,同时接受顺铂+氟尿嘧啶每三周一次,最多6个周期。
数据显示,23例晚期食管鳞癌患者接受CS1001联合CF化疗方案治疗后,18例患者被纳入有效性分析集,其中14(77.8%)例患者达到了RECIST V1.1标准定义的部分缓解(PR)。客观缓解率(ORR)可达到77.8%(14例),疾病控制率(DCR)高达88.9%。起效的14例患者疗效持续时间也较长,到报道为止,所有起效患者均未出现进展。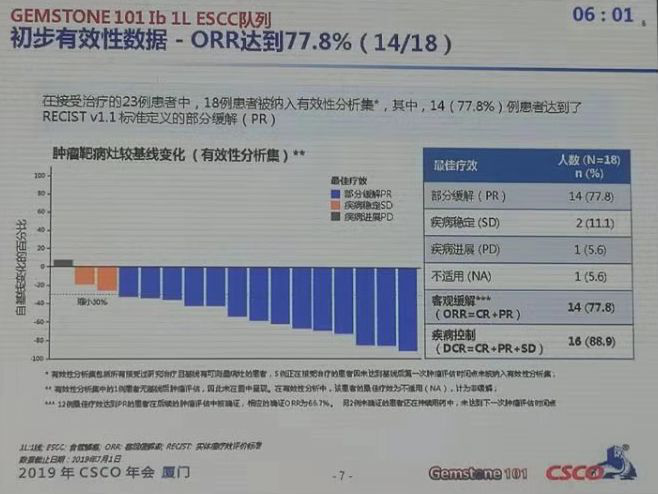
▲图片来源:CSCO大会现场汇报
在安全性方面,78.3%的患者(18例)出现了3级以上不良事件,13%(3例)的患者因不良事件终止了治疗。与联合治疗方案治疗相关的不良事件包括贫血、中性粒细胞计数降低、白细胞计数降低、恶心和食欲下降等。
食管鳞癌是中国特色恶性肿瘤,数据显示,中国食管癌新发病例和死亡病例占全世界50%以上,且90%以上患者为鳞状细胞癌。CS1001联合CF化疗方案作为一线治疗晚期食管鳞癌表现出良好的抗肿瘤活性,客观缓解率达到77.8%,且缓解可持续。初步数据令人鼓舞,不过在安全性及耐受性方面有待进一步观察。
此次恒瑞医药也在CSCO大会上展现了多项研究结果。其中,ESCORT研究是一项探索恒瑞医药PD-1抗体卡瑞利珠单抗治疗食管鳞癌患者的随机、开放、化疗药对照、多中心3期临床研究,患者人群为既往接受一线化疗失败的晚期/转移性食管鳞癌患者。研究所纳入的患者被随机分配进入卡瑞利珠单抗组(228例)和对照组(220例),前者给予卡瑞利珠单抗单药治疗(200mg,每2周给药一次),对照组给予多西他赛(75mg/m2,每3周给药一次)或伊立替康(180 mg/m2,每2周给药一次)。
研究主要研究终点为总生存期(OS),次要研究终点包括无进展生存期(PFS)、客观缓解率(ORR)等。数据显示,ESCORT研究达到了主要研究终点,卡瑞利珠单抗治疗后患者OS优于化疗。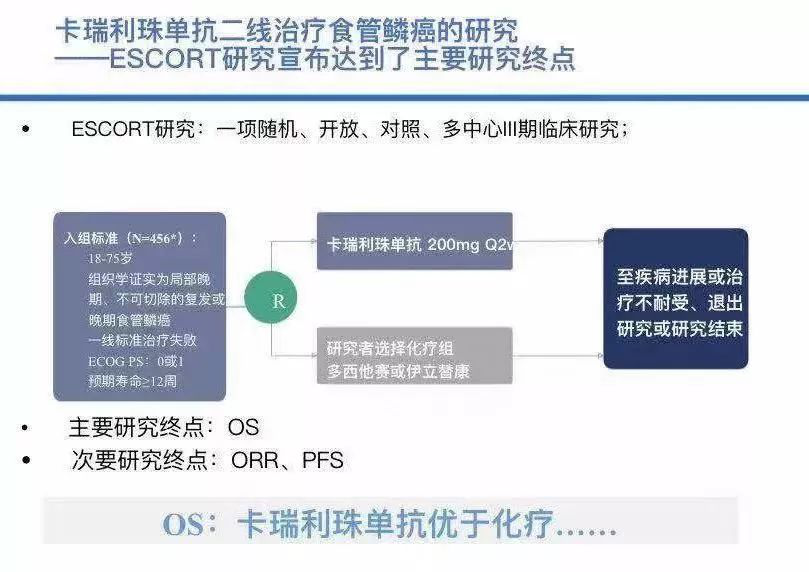
另一项探索卡瑞利珠单抗联合阿帕替尼和化疗(紫杉醇脂质体+奈达铂)一线治疗晚期食管鳞癌的2期临床研究,共纳入30例不可切除的局部晚期或转移性晚期食管鳞癌患者。研究显示,卡瑞利珠单抗联合阿帕替尼和化疗治疗,患者客观缓解率高达80%,疾病控制率达96.7%,且不良反应可控、可预期。这一结果也证实了化疗药物与PD-1/PD-L1抑制剂、抗血管生成类药物联合使用可增强免疫治疗的效果,对于局部晚期或转移性晚期食管鳞癌患者而言有望成为新的治疗选择。3期试验达主要终点,信达生物两款生物类似药获积极结果
此次CSCO年会上,信达生物公布了IBI301(利妥昔单抗生物类似药)两项研究的数据。信达生物与礼来制药(Lilly)以原研药利妥昔单抗注射液作为对照,共同开展了IBI301在经治达到完全缓解的CD20阳性B细胞淋巴瘤患者中的药代动力学(PK)比对研究,以及在CD20阳性DLBCL初治患者中的临床有效性比对研究,以评价IBI301与原研药利妥昔单抗注射液的临床相似性。结果显示,两项主要比对研究均达到主要研究终点。在经治达到CR的CD20阳性B细胞淋巴瘤中开展的IBI301与原研药利妥昔单抗注射液的PK比对研究共入组181例受试者,IBI301组89例,原研药组92例。IBI301组与原研药组的主要PK指标(AUC0-inf)达到了等效。
而IBI301在初治DLBCL中的3期有效性比对研究中,IBI301组和原研药组经中心影像评估的ORR分别为89.9%和93.8%。研究达到了主要研究终点,证实了IBI301与原研药利妥昔单抗用于DLBCL初治患者的临床疗效等效,且安全性相似。
▲贝伐珠单抗的作用机理(图片来源:参考资料[6])
另一款贝伐珠单抗生物类似药IBI305,信达生物在CSCO上公布了该药对比贝伐珠单抗联合紫杉醇/卡铂一线治疗晚期非鳞非小细胞肺癌患者的有效性和安全性的随机、双盲3期研究结果。数据显示,经中心影像评估的更新客观缓解率分别为47.1%和46.8%,由研究者评估的中位PFS分别为7.3个月和7.5个月,无统计学差异。
两项3期试验的结果均显示,IBI301和IBI305与对应的原研药相比达到了临床相似性,且安全性和耐受性良好。目前,这两款生物类似药的上市申请均已被中国国家药监局受理,并被纳入优先审评。生物类似药上市后有望进一步减轻患者的负担,惠及广大患者及其家庭。
总的来看,中国本土企业研发的抗癌产品已逐渐成为CSCO大会的亮点。尤其是CS1001和卡瑞利珠单抗在晚期食管癌治疗中取得的成果,意味着免疫治疗的出现有望打破ESCC现有的治疗瓶颈。随着免疫检查点抑制剂PD-1/PD-L1单抗在各大癌种中收获越来越多的适应症,更多患者开始获益于免疫治疗时代下的创新疗法。我们期待在大会上看到更多的重磅研究和积极结果,同时也应注意到:免疫疗法在带来惊艳疗效的同时,也给患者带来了不同程度的不良反应。这就需要针对免疫治疗进行全程管理,从而使患者的生存和生活质量得到保证,令患者获益最大化。









