祐和医药成立于2016年,位于北京亦庄生物医药产业园,由倪健博士和沈月雷博士共同成立,专注于开发具有自主知识产权的创新型抗体新药。YH001是祐和医药开发的首款在研CTLA-4抗体,通过提高机体自身针对肿瘤细胞的免疫应答,强化肿瘤微环境中调节性T细胞(Treg cell)的去除,从而治疗肿瘤。

这款药的作用机制颇受关注。大家知道,在肿瘤治疗领域,CTLA-4和PD-1一样作为肿瘤免疫疗法的重要靶点被寄予厚望。尤其是全球首款CTLA-4抗体Ipilimumab已于2011年获批,用于治疗晚期黑色素瘤,而且2018年Ipilimumab的发明人James P. Allison 教授还获得了诺贝尔生理或医学奖。近两年CTLA-4免疫检查点学说受到挑战。有新的研究指出,抗CTLA-4抗体发挥治疗肿瘤功效的主要分子机制是通过清除肿瘤局部的调节性T细胞(Treg cell),而非通过阻断CTLA-4/B7相互作用的抑制性信号通路。这为CTLA-4抗体的研发开辟了新的思路。
据悉,祐和医药针对十多个肿瘤免疫检查点靶点进行了广泛的单靶点和多靶点联用研发,他们基于动物体内药效学数据,认为CTLA-4靶点新作用机理的发现,有望大幅改变肿瘤免疫联合用药和双特异性抗体的研发格局。在此基础之上,祐和新药重新设计了CTLA-4抗体的研发思路,并采用基于动物体内药效数据进行抗体筛选,最终获得YH001抗体。临床前研究中,YH001极高的亲和力和优秀的安全表现,以及在动物药效实验中显现出的联合用药巨大潜力,充分验证了祐和研发团队的设想。
祐和医药首席执行官赵大尧博士表示,公司两年半时间,将第一个自主研发的产品推进到临床阶段,这是公司的重要里程碑。未来半年公司还将递交2~3个自主研发产品的临床申请。
从祐和医药官网信息来看,自公司成立以来就颇受资本青睐。成立伊始即获得百奥财富、国投创业共同出资的6000万元A轮融资。次年,两家投资方共同追加完成对祐和医药的7000万元A+轮投资。2018年3月,公司再次完成由招银国际资本领投,本草资本跟投的1.2亿元人民币B轮融资。
在资本的加持之下,公司聚焦肿瘤免疫领域,很快建立起了研发管线,并获得快速成长。据悉,目前祐和医药已构建起针对十多个靶点的研发管线,其中2款在研产品在美国申报临床,还有3款即将申报临床。
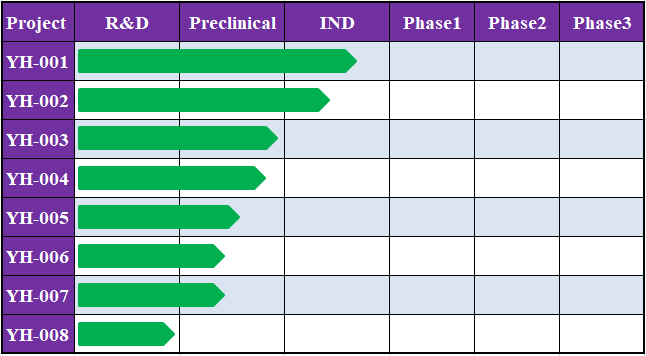
▲祐和医药研发管线(数据来源:祐和医药官网)

