10月16日,中国国家药监局药品审评中心(CDE)网站显示,德国默克(Merck KGaA)新药tepotinib片的2期单组试验(VISION)已在中国获批临床,适应症为:具有MET外显子14(METex14)跳跃突变或MET扩增的晚期(局部晚期或转移性)非小细胞肺癌。Tepotinib是德国默克开发的一种高选择性口服MET抑制剂,就在上个月,这款候选药还获得了美国FDA授予的突破性疗法认定。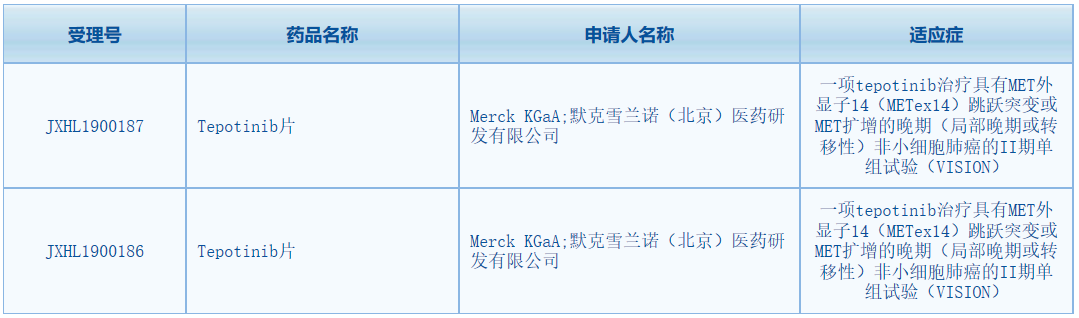
肺癌是“癌症之首”,发病率和死亡率在所有癌症中均居第一位。而在占了肺癌80%-85%的非小细胞肺癌(NSCLC)中,3-5%的患者会出现MET基因扩增或外显子14发生突变。由于尚未有针对MET基因的靶向疗法获批上市,所以这类肺癌患者的预后情况也不容乐观。在肿瘤免疫疗法盛起的时代,MET抑制剂已然成为热门研究方向之一。Tepotinib是德国默克开发的一种高选择性口服MET抑制剂。c-Met信号通路在各种癌症类型中都发现有改变,并与侵袭性肿瘤行为和不良的临床预后相关。Tepotinib被设计用于改善预后较差并保有这些特定突变的侵袭性肿瘤的预后。在MET过度表达或扩增的NSCLC患者中,tepotinib显示出了抗肿瘤活性。一项正在进行的名为VISION的2期临床研究中对73名经过组织活检或液体活检确认携带MET外显子14跳跃突变的转移性NSCLC患者进行了疗效评估。
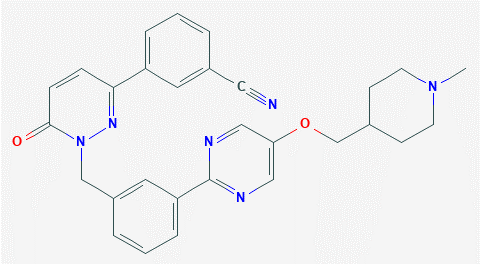
▲Tepotinib分子结构式(图片来源:PubChem)
试验数据显示:对于经过液体活检确认的患者,独立评估委员会(IRC)得到的总体缓解率为50.0%,研究人员的结果为55.3%;而对于通过组织活检确认的患者,这两个数字分别为45.1%和54.9%。从中位缓解持续时间(DOR)来看,对于经过液体活检和组织活检确认的患者,IRC给出的数字分别是12.4个月和15.7个月,研究人员给出的结果分别是17.1个月和14.3个月。基于上述出色的临床试验结果,2019年9月,美国FDA授予了tepotinib突破性疗法认定,用于治疗携带MET外显子14跳跃突变的转移性非小细胞肺癌(NSCLC)患者。此外值得注意的是,tepotinib此前已在日本获得快速通道资格;在中国,tepotinib联合奥希替尼治疗具有EGFR活化突变且对第1至3代EGFR酪氨酸激酶抑制剂获得性耐药后MET扩增的晚期或转移性NSCLC患者的2期、单臂研究已在今年9月底刚刚获批临床。在中国,已有多家公司布局这一领域,包括贝达药业、豪森药业、和记黄埔医药、海和生物等。我们期待tepotinib在中国的临床研究能够顺利进展并取得好的效果,早日为中国患者带来新的治疗选择。



