近日,阿斯利康(AstraZeneca)宣布,美国FDA已批准其SGLT2抑制剂达格列净(dapagliflozin,商品名为Farxiga),用于降低患有2型糖尿病和其他心血管疾病风险的成年人因心力衰竭而住院的风险。值得一提的是,达格列净目前正在中国进行监管审查,预计将于2020年上半年作出决定。此前该药曾获得FDA授予的两项快速通道资格,分别用于治疗心力衰竭成人患者,及用于延缓肾功能衰竭进展并预防慢性肾病患者的心血管和肾脏死亡风险。
心力衰竭是由于心脏无法将足够的血液泵到身体各处而导致的危及生命的严重疾病。世界上有大约6400万患者(其中一半属于射血分数下降类型),接近一半患者在确诊5年内去世。心衰是65岁以上老年人住院的首要原因之一,代表着严重的临床和经济负担。
达格列净是一款“first-in-class”口服钠-葡萄糖共转运蛋白2(SGLT2)抑制剂。SGLT2是肾脏内协助葡萄糖重吸收的转运蛋白。SGLT2抑制剂通过抑制SGLT2的功能,让更多葡萄糖从尿液中排走,从而降低血液中的葡萄糖水平。此前,达格列净已经获得FDA批准,与饮食和锻炼一起,改善2型糖尿病患者的血糖控制,并且可以降低他们的体重和血压。它还获得欧盟批准,用于治疗1型糖尿病患者。
此次FDA对达格列净的这一批准主要基于一项名为DECLARE-TIMI 58心血管预后研究(CVOT)。根据阿斯利康公告,该研究是迄今为止在广泛的患者群体中针对SGLT2选择性抑制剂进行的最大的CVOT。这是一项随机、双盲、安慰剂对照的多中心3期研究,旨在评估达格列净与安慰剂相比,对具有心血管事件风险(包括多种心血管风险因子或已确诊的心血管疾病)的成年2型糖尿病患者在心血管结局上的效果。研究纳入了来自33个国家、882个中心的1.7万多例患者。

研究结果表明,达格列净与安慰剂相比,心力衰竭或心血管死亡这一主要复合终点的风险显著降低了17%(4.9% vs 5.8%;HR 0.83 [95%CI 0.73-0.95],p = 0.005)。这一发现是由于心力衰竭风险显著降低了27%(2.5% vs 3.3%;HR 0.73 [95%CI 0.61,0.88])。各患者亚组的治疗获益均一致。这一结果同时还确认了达格列净的安全性。目前,该试验的全部结果已于今年1月发表在《新英格兰医学杂志》上。
阿斯利康生物制药业务部执行副总裁Ruud Dobber表示:“达格列净是美国FDA批准的首个可降低患有心血管疾病或具有多种心血管危险因素的2型糖尿病患者因心衰住院风险的SGLT2抑制剂。对于美国3000万患有2型糖尿病的人来说,这是一个令人鼓舞的消息,因为在心脏病发作或中风之前,心力衰竭是他们最早的心血管并发症之一。现在,达格列净为医生提供了机会,使他们能够尽快采取行动,减少患者因心力衰竭而住院的风险。”
美国波士顿布里格姆妇女医院、TIMI研究小组资深研究员和该试验的共同负责人Stephen Wiviott博士表示:“DECLARE-TIMI 58是具有里程碑意义的试验,为达格列净提供了令人信服的证据,即它可降低患有多种心血管疾病危险因素的2型糖尿病患者发生心力衰竭的风险。这些数据可以帮助我们改变治疗糖尿病的方法,超越对血糖控制的单一关注,以帮助解决不同患者群体中出现心力衰竭的风险。”
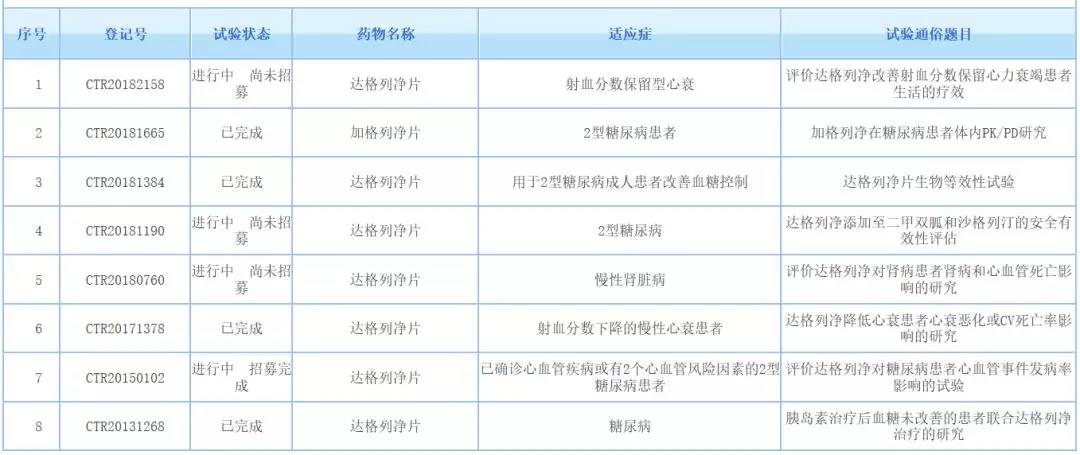
在中国,达格列净已在2017年正式被批准,该药也因此成为在中国上市的首个SGLT2抑制剂。根据药物临床试验登记与信息公示平台,该药已在中国登记开展了8项临床试验。这些研究有望支持达格列净在中国进一步拓展新的适应症。另外,今年6月,阿斯利康已向中国国家药监局递交了该药新适应症的两项上市申请(受理号为JXHS1900076和JXHS1900077)。根据阿斯利康公告,达格列净目前正在中国进行监管审查,预计将于2020年上半年作出决定。在全球范围内,达格列净有稳健的临床研究计划,在超过35项已完成和正在进行的2b/3期研究中有超过3.5万例患者参加。心力衰竭在全球范围内影响着约6400万人,其中约一半的患者在诊断后五年内死亡。我们祝贺阿斯利康,也希望这款新药能够尽快在中国获批新适应症,从而为更多患者带来福音。





