KRAS抑制剂可谓是2019年“年度最火爆”的业界焦点之一。昨日,Mirati Therapeutics公司刚刚公布了其KRAS G12C抑制剂MRTX849的首批临床试验结果,今日勃林格殷格翰(Boehringer Ingelheim)公司便又有相关好消息传出。在第31届国际分子靶标与癌症治疗大会(AACR-NCI-EORTC International Conference on Molecular Targets and Cancer Therapeutics)上,该公司展示了其首款靶向所有主要KRAS突变体(pan-KRAS)的抑制剂BI 1701963的临床前积极数据,并宣布推进这款在研药物进入临床开发阶段,单药或与MEK抑制剂trametinib联用,治疗不同类型的晚期实体瘤患者。这款pan-KRAS抑制剂有望阻断15%的癌症中KRAS突变体的活性。

KRAS基因是人类癌症中最常出现突变的致癌基因。据统计,KRAS基因突变出现在近90%的胰腺癌,30-40%的结肠癌,和超过30%的肺腺癌中。然而,由于KRAS蛋白表面没有适于小分子抑制剂结合的口袋,导致靶向KRAS的小分子药物开发曾经在40年里没有重大突破。直到最近在研发人员的不懈努力下才将KRAS G12C抑制剂推进到临床阶段。但是除了KRAS G12C之外,还有许多KRAS基因的突变会驱动肿瘤的生长,例如KRAS G12D和KRAS G12V。
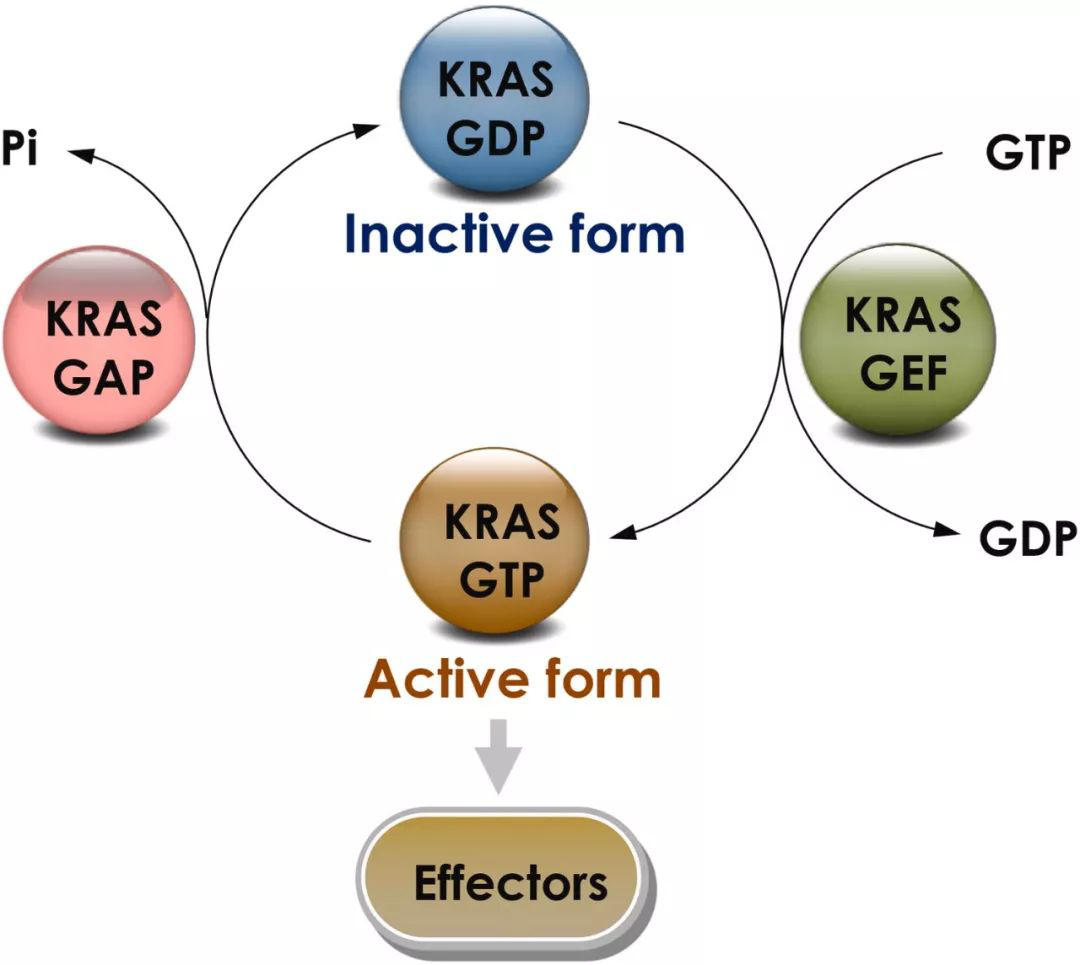
在细胞内,KRAS蛋白在失活和激活状态之间转变,当KRAS与鸟苷二磷酸(GDP)结合时,它处于失活状态,当它与鸟苷三磷酸(GTP)结合时,它处于激活状态,并且可以激活下游信号通路。KRAS在失活与激活状态之间的转换受到两类因子的调节。一类是鸟嘌呤核苷酸交换因子(GEF),这类蛋白催化KRAS与GTP的结合,从而促进KRAS的激活,其中包括SOS1蛋白。另一类是GTP酶激活蛋白(GAP),这类蛋白能够促进与KRAS结合的GTP水解成为GDP,从而抑制KRAS的活性。
勃林格殷格翰的BI 1701963是一款口服的特异性SOS1抑制剂,它通过与SOS1蛋白的结合来抑制KRAS的活性。临床前数据表明,pan-KRAS抑制剂可以抑制KRAS G12和KRAS G13突变体的活性,从而达到减缓肿瘤生长的目的。在非临床研究中,BI 1701963与MEK抑制剂联用,表现出对KRAS信号传导的显著影响,并通过互补作用机制提高了抗肿瘤活性。日前,勃林格殷格翰公司也与Lupin Pharmaceuticals公司达成研发协议,将探索KRAS抑制剂与Lupin公司的新型MEK抑制剂LNP3794构成组合疗法在临床试验中的疗效。
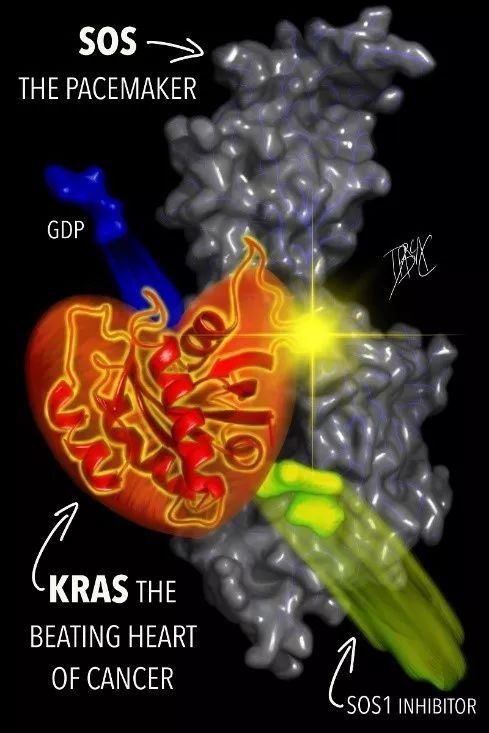
▲SOS1抑制剂的工作机理示意图(图片来源:参考资料 [1])
“我们的pan-KRAS抑制剂旨在靶向包括G12和G13在内的多种KRAS突变体,“勃林格殷格翰全球癌症研究负责人Norbert Kraut博士说:”有效地靶向最普遍的KRAS突变,可使我们为治疗选择有限的胃肠道和肺癌患者开发出他们急需的新治疗方案。”

