根据中国国家药监局药品审评中心(CDE)网站最新公示,Incyte与信达生物联合提交的成纤维细胞生长因子受体(FGFR)抑制剂pemigatinib片、PI3Kδ抑制剂parsaclisib片临床试验申请已获得默示许可。其中pemigatinib适应症为胆管癌,parsaclisib片适应症为复发/难治滤泡性淋巴瘤和边缘区淋巴瘤。至此,Incyte与信达这对“CP”联合开发的三款药中,已经有两款在中国获批临床。还有一款JAK1抑制剂itacitinib的临床申请已于今年8月获得CDE受理。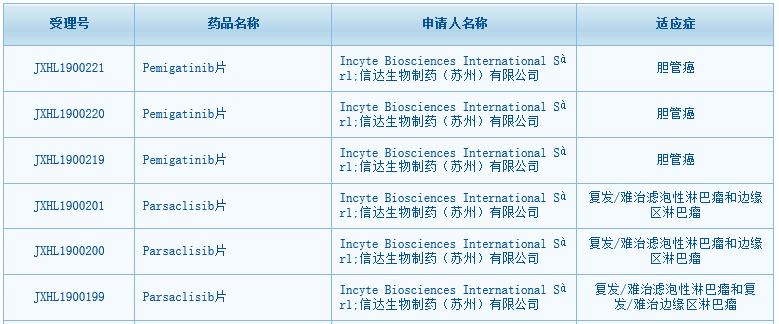
▲pemigatinib片和parsaclisib片获批临床(图片来源:CDE官网)Pemigatinib、parsaclisib和JAK1抑制剂itacitinib均由Incyte发现和开发,2018年12月,信达生物以高达约3.9亿美元(含4000万美元首付款)的总金额获得了这三款在研候选药物针对血液病和肿瘤适应症在大中华区(含中国大陆及港澳台地区)的开发和商业化权利。合作达成后,Incyte与信达生物快速推进这三款药物在中国的临床申报。截至目前,双方已经在中国提交了涉及这三种药物的共计10项临床试验申请。
Pemigatinib是一款针对FGFR亚型1/2/3的强效选择性口服抑制剂。FGFR在肿瘤细胞增殖、存活、迁移和血管生成(新血管的形成)中发挥重要作用,FGFR基因融合/重排、易位和扩增极可能导致多种癌症的发生。在美国,pemigatinib已获得突破性疗法认定,用于治疗既往经治的晚期/转移性或不可切除的FGFR2基因易位型胆管癌。在今年10月召开的2019年欧洲肿瘤内科学会(ESMO)上,Incyte 公布了pemigatinib治疗复发晚期胆管癌患者的2期临床试验结果:在既往经治的局部晚期或转移性胆管癌伴FGFR2基因融合或重排的患者中,pemigatinib单药治疗后的总体缓解率(ORR)为36%(主要终点),疾病控制率(DCR)达82%,中位缓解持续时间(DOR)达7.5个月,中位无进展生存期(PFS)为6.9个月(次要终点),且总体耐受性良好。胆管癌是一种发生于胆管的恶性肿瘤,根据其起源部位可以分为肝内胆管癌和肝外胆管癌。胆管癌患者通常在诊断时已处于疾病后期或晚期,但是对于晚期胆管癌,目前没有获批的全身性疗法,患者的化疗选择也非常有限,预后较差。Parsaclisib是针对PI3Kδ的新型口服抑制剂,对于抑制PI3Kδ在恶性B细胞淋巴瘤的生长、存活中起到重要作用。在临床前研究中,parsaclisib展现出了高选择性和有效性,这意味着该药有潜力为淋巴瘤及其它恶性血液肿瘤患者提供临床获益。目前,Incyte公司正在中国境外开展CITADEL系列的2期临床研究,以探索该产品针对非霍奇金淋巴瘤的疗效和安全性。此外,parsalisib在骨髓纤维变性、局部晚期或转移的实体瘤以及弥漫性大B细胞淋巴瘤里均开展了相应的1期和2期临床研究。
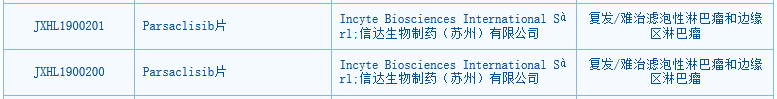
▲parsalisib获批临床(图片来源:CDE官网)今年8月,parsaclisib的临床试验申请获得中国国家药监局药品审评中心(CDE)受理,并于近日获得临床试验默示许可。Itacitinib是新型、高效、选择性抑制JAK1信号通路的小分子抑制剂,该药的临床试验申请已于今年8月获得CDE受理。根据Incyte公司今年发布的二季度报告,itacitinib目前正在开展两项针对移植物抗宿主病的3期临床试验,并完成了该药与EGFR抑制剂奥希替尼组合二线治疗EGFR突变阳性非小细胞肺癌(NSCLC)的1/2期临床研究。我们祝贺Incyte与信达生物联合开发的FGFR抑制剂pemigatinib、PI3Kδ抑制剂parsaclisib在中国获批临床,希望它们的临床试验能够顺利开展并取得好的结果,早日为患者带来更多的治疗选择!





