继今年4月获得美国FDA批准后,杨森制药开发的抗癌药erdafitinib在中国已申报临床。这是全球首款膀胱癌个体化疗法!今日,中国国家药监局药品审评中心(CDE)最新公示,强生集团(Johnson & Johnson)旗下杨森(Janssen)公司开发的口服泛FGFR抑制剂erdafitinib片已经申报临床,并获得受理。这意味着,这款重磅膀胱癌治疗药物将有望在中国开展临床研究,在不久的将来为膀胱癌患者带来福音。Erdafitinib是FDA批准的首款针对转移性膀胱癌的靶向疗法,它曾经获得FDA授予的突破性疗法认定,该药物的新药申请也获得了优先审评资格。
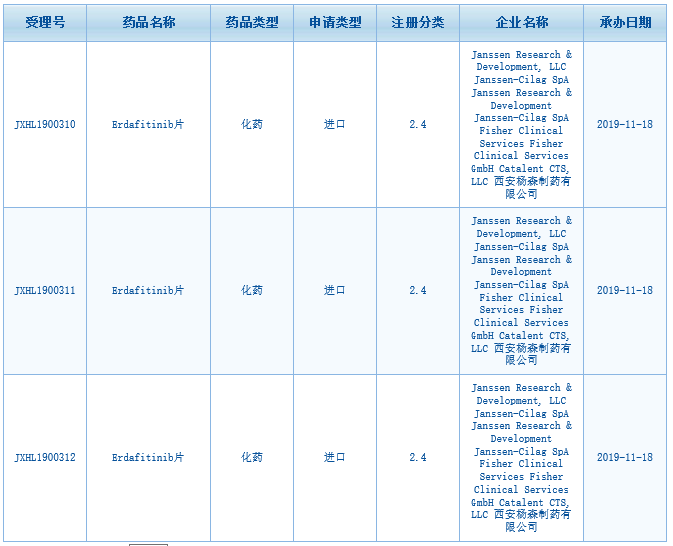
▲Erdafitinib在华申报临床并获受理(图片来源:CDE截图)
作为一款成纤维细胞生长因子受体(FGFR)抑制剂,erdafitinib能够靶向FGFRs的特定基因突变。大家知道,最常见的膀胱癌为尿路上皮癌,这种癌变通常与患者膀胱或尿路上皮细胞中出现的基因突变相关。FGFRs是一个受体酪氨酸激酶家族,调节细胞生长和分裂等重要生理过程,在不同肿瘤中出现的基因突变会导致它们被激活。FGFR中出现的突变出现在大约1/5的复发/难治性膀胱癌患者中。
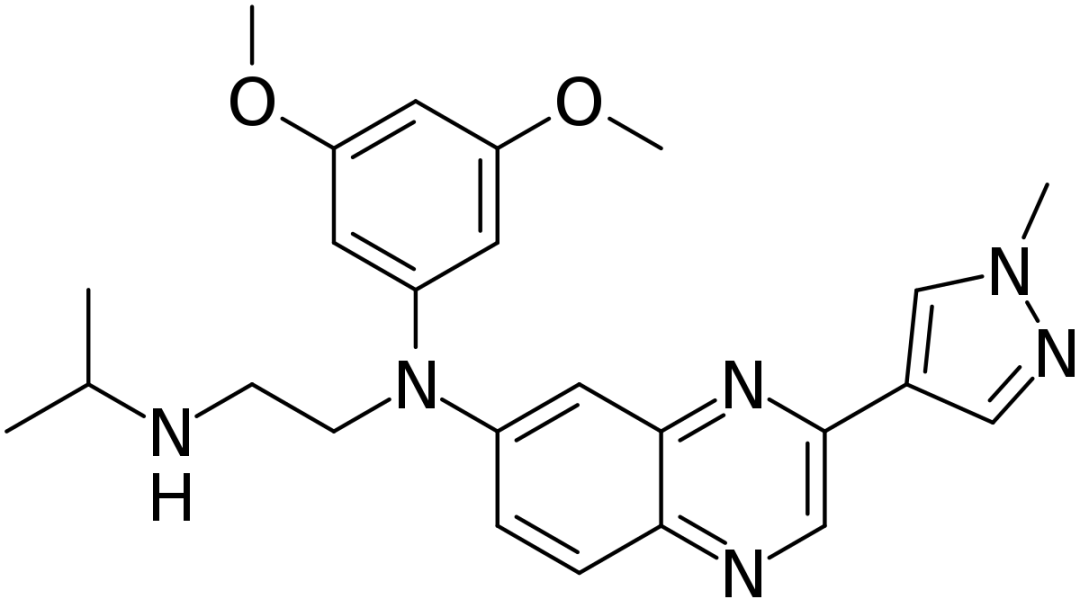
▲Erdafitinib的分子结构式(图片来源:Ed (Edgar181) [Public domain])
今年4月,美国FDA宣布加速批准Balversa(erdafitinib)上市,治疗接受铂基化疗后疾病仍然进展的局部晚期或转移性膀胱癌成人患者。这些肿瘤携带特定致敏性FGFR3或FGFR2基因突变。患者需要接受FDA批准的伴随诊断来确认适合接受erdafitinib治疗。尿路上皮癌治疗很长时间以来都没有取得显著突破。Erdafitinib作为一种口服泛FGFR抑制剂,可以说是一种重要的创新疗法,它的诞生给部分治疗选择有限的尿路上皮癌患者带来了新的希望。
据悉,FDA的批准是基于一项erdafitinib在包含87名局部晚期或转移性膀胱癌患者的2期临床研究结果。据悉,该研究中的患者携带特定FGFR3或FGFR2基因突变,在这些接受过化疗并且疾病继续进展的患者中,erdafitinib达到了32.2%的总缓解率,其中2.3%的患者达到完全缓解。患者平均缓解持续时间达到5.4个月。与此同时,这些患者中25%接受过抗PD-L1/PD-1肿瘤免疫疗法,erdafitinib对那些对抗PD-L1/PD-1疗法没有反应的患者也产生了疗效。对于这款新药获批,美国FDA肿瘤卓越中心主任Richard Pazdur博士早前表示,当前处于个体化疗法和精准疗法的时代,根据患者携带的特定基因突变提供靶向疗法正在成为治疗癌症的标准。该药物的批准,代表着第一款针对携带特定FGFR基因突变的转移性膀胱癌患者的个体化疗法。膀胱癌是泌尿系统最常见的恶性肿瘤,也是全身十大常见肿瘤之一。公开信息显示,全球世界范围内,膀胱癌位列男性最常见实体瘤的第四位,在女性位列第七位。在中国,该癌症占泌尿生殖系肿瘤发病率的第一位,其中大多数起源于移行上皮。近年来中国部分地区膀胱癌发病率呈现稳中有升趋势,好发年龄51~70岁,发病高峰为65岁。
祝愿这款药物能够顺利获批临床,顺利开展临床研究,早日为膀胱癌患者带来治疗的曙光。



