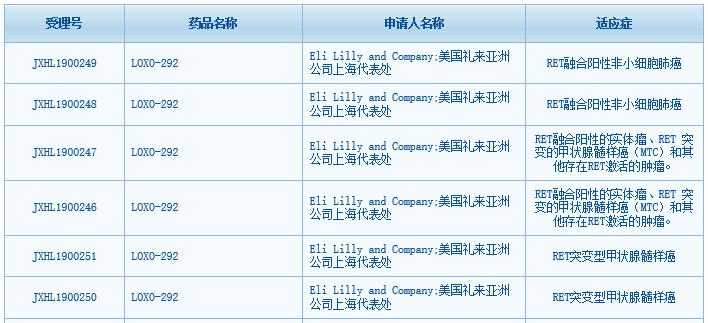
根据中国国家药监局药品审评中心(CDE)网站最新数据显示,礼来公司(Eli Lilly)旗下RET靶向抑制剂selpercatinib(LOXO-292)已在中国获得6项临床试验默示许可,适应症为:RET融合阳性非小细胞肺癌(NSCLC),以及RET融合阳性的实体瘤、RET 突变的甲状腺髓样癌(MTC)和其他存在RET激活的肿瘤。
值得一提的是,由于RET致癌基因存在于NSCLC、甲状腺髓样癌、甲状腺癌、直肠癌、乳腺癌、胰腺癌等多种癌症中,它也是“不限癌种”疗法的重要信号通路之一。今年初,礼来斥资80亿美元收购了Loxo Oncology公司,囊获了后者包括selpercatinib在内的一系列在研药物。目前,全球尚未有针对RET的靶向药物获批。严格来说,目前中国尚未有一款“不限癌种”创新疗法获批上市。
RET基因融合,是指表达RET受体的基因与其它基因融合,导致RET受体的酪氨酸激酶活性持续激活。它和RET激活性基因突变一样,导致RET信号通路的持续活跃,是驱动癌症发生的重要因子。RET基因融合出现在约2%的NSCLC患者中,10%~20%的甲状腺癌患者中,而RET激活性基因突变出现在60%的甲状腺髓样癌患者中。携带RET基因变异的癌症主要依靠这一蛋白激酶的异常激活促进它们的增殖和生长,因此这些癌症对RET抑制剂非常敏感。
Slpercatinib是由精准疗法明星公司Loxo Oncology研发的一款具有高度特异性的口服RET抑制剂,2019年1月,礼来斥资80亿美元收购了Loxo Oncology公司。在美国,selpercatinib已经获得美国FDA授予的突破性疗法认定,用于治疗携带RET基因融合的NSCLC和甲状腺癌,以及携带RET激活性基因突变的甲状腺髓样癌。

今年9月,礼来在第20届世界肺癌大会上公布一项名为LIBRETTO-001的1/2期临床试验的出色数据。其中,105名经治NSCLC患者接受了selpercatinib的治疗。试验结果表明:截至2019年6月17日,selpercatinib在这些接受过多种前期治疗的患者中达到68%的客观缓解率,其中完全缓解率为2%;在出现大脑转移瘤的患者亚群中,selpercatinib表现出高达91%的中枢神经系统客观缓解率,完全缓解率达到18%。此外,在针对34名携带RET基因融合的初治NSCLC患者中,selpercatinib也达到85%的客观缓解率。
除了NSCLC适应症外,selpercatinib在甲状腺癌患者中也取得了积极的结果。根据礼来在2019年欧洲肿瘤内科学会(ESMO)上公布的数据:
在携带RET突变的经治甲状腺髓样癌患者中(这些患者中53%接受过超过2种多激酶抑制剂的治疗),selpercatinib达到56%的客观缓解率;
在未接受过cabozantinib/vandetanib治疗的RET突变阳性甲状腺髓样癌患者中,selpercatinib达到59%的客观缓解率;
在接受过多种前期疗法治疗的RET基因融合阳性的甲状腺癌患者中,selpercatinib达到62%的客观缓解率。

