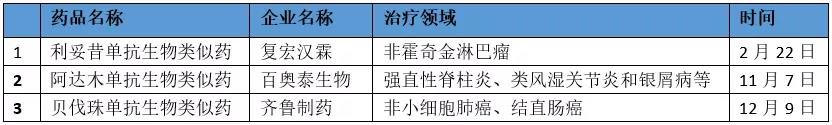
随着近日首款中国国产贝伐珠单抗生物类似药的获批,2019年已有3款中国国产生物类似药获批,且均为重磅产品。它们分别是,来自复宏汉霖的首款国产利妥昔单抗生物类似药、来自百奥泰生物的首款国产阿达木单抗生物类似药,以及来自齐鲁制药的首款贝伐珠单抗生物类似药。可以说,这是即将过去的这一年,中国生物医药产业在生物类似药研发领域取得的重大进展和突破。
2月22日,中国国家药监局批准复宏汉霖研制的利妥昔单抗注射液(商品名:汉利康)上市,用于非霍奇金淋巴瘤的治疗。这是中国国内获批的首个生物类似药。非霍奇金淋巴瘤是一种起源于淋巴系统的恶性肿瘤,可发生于任何年龄人群。此次获批的利妥昔单抗注射液用于治疗非霍奇金淋巴瘤包括三个亚类:复发或耐药的滤泡性中央型淋巴瘤的治疗;先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤;以及CD20bj性弥漫大B细胞性非霍奇金淋巴瘤。利妥昔单抗是全球领域的一款重磅药物,由Genentech公司原研,且是美国FDA批准的首个治疗癌症的单克隆抗体。由复宏汉霖申报的利妥昔单抗生物类似药是中国首家以利妥昔单抗为参照药、按照生物类似药途径研发和申报生产的产品。按照中国国家药监局 “支持生物类似药、具有临床价值的药械组合产品的仿制”的要求,这款生物类似药被纳入优先审评审批程序,加快了上市速度。
11月7日,中国迎来了第2款国产生物类似药。当日,中国国家药监局“官宣”批准百奥泰生物研制的阿达木单抗注射液(商品名:格乐立)上市。它是中国获批的首个阿达木单抗生物类似药,适应症为强直性脊柱炎、类风湿关节炎和银屑病等自身免疫性疾病。
阿达木单抗注射液是全球首个获批上市的全人源抗肿瘤坏死因子ɑ(TNF-ɑ)单克隆抗体,可特异性地与可溶性人TNF-ɑ结合并阻断其与细胞表面TNF受体p55和p75的相互作用,从而有效地阻断TNF-ɑ的致炎作用。除此之外,阿达木单抗还可能通过结合跨膜TNF-ɑ,产生抗体依赖的细胞介导的细胞毒性作用(ADCC)、补体依赖的细胞毒作用(CDC)、诱导细胞凋亡等效应,清除一部分致病的靶细胞。此次获批的阿达木单抗注射液是由百奥泰生物申报,是中国首家以原研阿达木单抗为参照药、按照生物类似药途径研发和申报生产的产品。
12月9日,中国国家药监局官宣批准齐鲁制药研制的贝伐珠单抗注射液(商品名:安可达)上市。该药是中国获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。
贝伐珠单抗是利用重组DNA技术制备的一种人源化单克隆抗体IgG1,通过与人血管内皮生长因子(VEGF)结合,抑制VEGF与其受体结合,阻断血管生成的信号传导途径,抑制肿瘤细胞生长。作为抗肿瘤血管生成的重要药物之一,已经被应用于多种恶性肿瘤的治疗。此次获批的贝伐珠单抗生物类似药是由齐鲁制药申报以原研贝伐珠单抗为参照药、按照生物类似药途径研发和申报生产的产品,且通过审评审批程序获批上市。
生物类似药,是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。通常,生物类似药上市被认为有助于提高生物药的可及性和降低价格,能够更好地满足公众对生物治疗产品的需求。
然而,由于生物药的研发和生产壁垒较高,在2019年之前中国尚未有国产生物类药获批上市。2015年2月,中国药品监管部门制订发布了《生物类似药研发与评价技术指导原则(试行)》。这为研发企业提供了方向,一部分中国医药研发企业快速布局生物类似药开发。
直至今年2月,中国首款生物类似药——由复宏汉霖研制的利妥昔单抗生物类似药的获批,使得该领域成功破冰。之后,百奥泰生物和齐鲁制药也拿下一些重磅生物类似药的”首款”称号。值得一提的是,根据中国国家药监局早前公开数据,目前中国已成为生物类似药在研药物数量最多的国家,先后有近200余个生物类似药临床申请获得批准,且部分在研产品已完成3期临床,并提交了上市申请。
我们很高兴看到,中国在2019年在生物类似药研发领域取得重大进展。这离不开中国一批生物医药企业和研发科学家们的努力,也离不开近年来中国国家药监局在加快药品审评审批,解决药品可及性问题方面做出的努力。希望这些药物能够为患者带来新的治疗选择,也希望未来可以看到更多新药好药的成功,为疾病治疗和人类健康发挥更大的能量。