今日,中国国家药监局药品审评中心(CDE)网站最新公示了诺华(Novartis)旗下涉及3款重磅产品的多项临床试验获得默示许可。其中涉及CDK4/6抑制剂LEE011、SHP2抑制剂TN0155,以及PD-1抑制剂PDR001这三款药物,获批临床的研究主要包括LEE011与TN0155的联合疗法治疗晚期恶性肿瘤、TN0155与LEE011联合或与PDR001联合用于特定晚期恶性肿瘤、以及PDR001单药治疗晚期恶性肿瘤等。
LEE011: 这是诺华研发的一款CDK4/6抑制剂(ribociclib)。2017年,LEE011获得美国FDA批准(商品名为Kisqali),与芳香酶抑制剂联合作为初始内分泌类治疗方案,用于绝经后激素受体阳性、人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。该药物曾经获得FDA颁发的突破性疗法认定和优先审评资格。
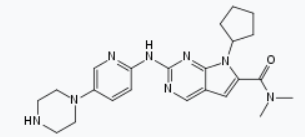
▲Ribociclib的分子式(图片来源:维基百科)
FDA的批准是基于关键性3期MONALEESA-2试验的良好数据,与单独使用来曲唑相比,Kisqali+来曲唑的联合方案显示了优越疗效和安全性。该试验招募了668名绝经后HR +/HER2-晚期或转移性乳腺癌妇女,她们未接受过针对晚期乳腺癌的全身性治疗。相比较于单独使用来曲唑14.7个月),Kisqali加上芳香酶抑制剂来曲唑可将进展或死亡的风险降低44%。同时,Kisqali+来曲唑显示了53%的总响应率的肿瘤负荷减少。Kisqali +来曲唑方案还显示了针对所有患者亚组的治疗益处,无论疾病负担或肿瘤位置。
TN0155: 是诺华正在开发的SHP2抑制剂,这是一款分子胶。SHP2是一种调节癌细胞生长信号通路的重要酪氨酸磷酸酶。但是传统靶向磷酸酶活性位点的抑制剂通常无法进入细胞或者具有很强的毒副作用。通过对SHP2进行异构调节,诺华公司的科学家们发现了分子胶TNO155。目前它在临床试验中,与Mirati Therapeutics公司的MRTX849联用,治疗携带KRAS G12C 突变的癌症患者。而将两种不同蛋白粘合在一起的分子间胶目前最火热的应用是作为靶向蛋白降解疗法。通过将靶点蛋白与细胞内负责蛋白降解的泛素-蛋白酶体系统中的E3连接酶连接起来,这种分子能够靶向降解多种致病蛋白。诺华已经成功使用这一技术降解超过70种靶点蛋白,在研发管线中有10个研发项目。PDR001:是诺华开发的一款PD-1抑制剂,又名spartalizumab。目前诺华正在多种癌症中开展PDR001单药疗法或与其它药物联合用药的临床试验。根据CDE网站信息,诺华目前已经在中国提交了6项PDR001的临床试验申请,本次刚获批的是PDR001单药治疗晚期恶性肿瘤的临床试验。此外,中国药物临床试验登记与信息公示平台显示,PDR001单药治疗晚期鼻咽癌患者的2期临床研究已经完成患者招募。在联合疗法中,诺华公司的MET抑制剂INC280(又名capmatinib)是PDR001的一个重要搭档。INC280最初由Incyte公司发现,2009年许可给诺华公司。今年9月,INC280获得FDA授予的突破性疗法认定,用于治疗携带MET基因外显子14跳跃突变的初治非小细胞肺癌(NSCLC)患者。早前,PDR001和INC280组合疗法针对曾接受治疗的EGFR野生型和ALK重排阴性的局部晚期或转移性NSCLC患者的临床试验申请已在中国获批。另外,PDR001单药或联合INC280治疗晚期肝细胞癌的Ib/2期研究正在招募中。此外,PDR001和B-RAF抑制剂dabrafenib和MEK抑制剂trametinib的三联疗法也正在携带BRAF V600突变的转移性黑色素瘤患者开展一项3期临床试验。2019年对诺华公司来说,是收获丰富的一年。根据公开信息,诺华正在加快在中国的开发力度。预计在2019-2023年间将在中国递交超过50项新药申请,是过去5年新药申请数目的两倍。诺华的目标是到2024年,90%在中国递交的新药申请将与全球监管申请的递交同时进行。
我们祝贺诺华一系列临床申请在中国获得默示许可,期待这些研究能够顺利开展并取得好的效果,早日为患者带来更多的治疗选择。



