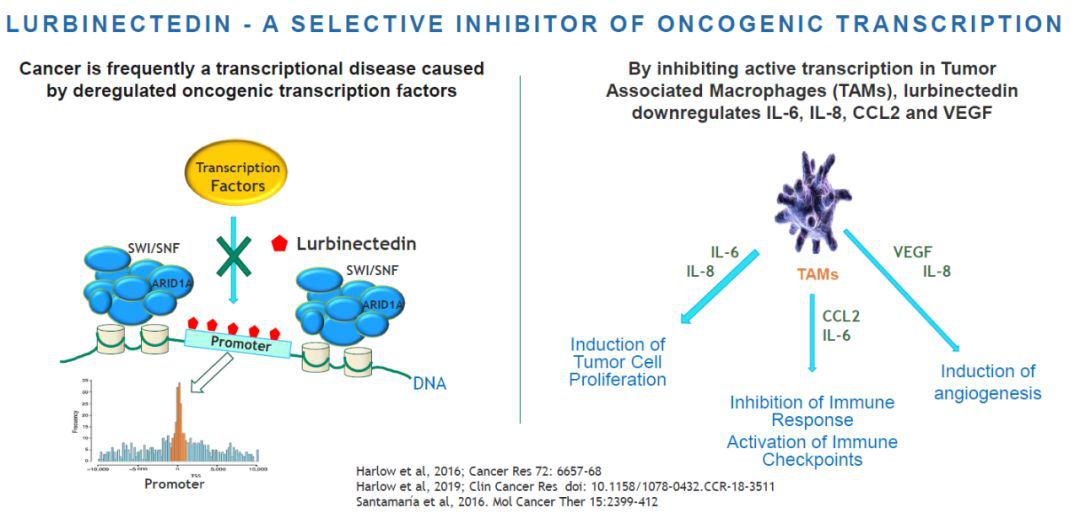
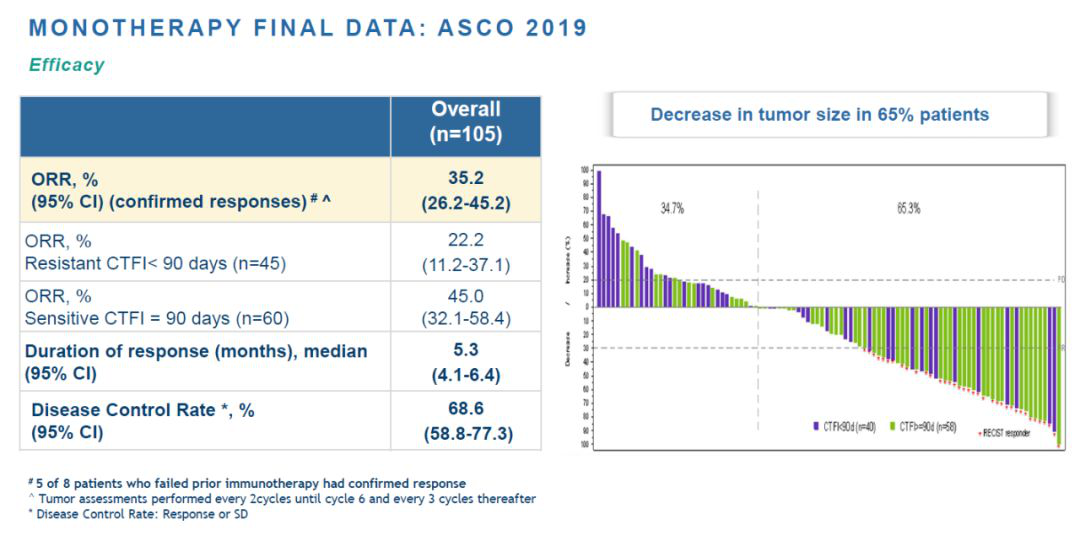
今日,PharmaMar公司宣布,该公司已经向美国FDA递交lurbinectedin的新药申请(NDA),治疗经过铂基化疗治疗后疾病进展的小细胞肺癌(SCLC)患者。这一申请的递交是基于加速批准条例。

肺癌无论在世界范围内是导致癌症死亡的首要原因,SCLC约占肺癌总数的10-15%。大部分SCLC患者在确诊时,疾病已经处于晚期。与NSCLC相比,SCLC的疾病进展速度更快,美国SCLC患者的5年生存率只有6%。
[1] PharmaMar has filed New Drug Application for lurbinectedin with the FDA for the treatment of relapsed small cell lung cancer. Retrieved December 17, 2019, from http://pharmamar.com/wp-content/uploads/2019/12/PR_Lurbinectedin_NDA_filing_USA_DEF.pdf
[2] PharmMar Coporate Presentation. Retrieved December 17, 2019, from http://pharmamar.com/wp-content/uploads/2019/09/Institutional-presentation-Oct-2019.pdf

