继今年10月与罗氏达成合作后,应世生物创新抗癌药IN10018片又迎来新进展。中国国家药监局药品审评中心(CDE)网站最新数据显示,IN10018片已在中国获得临床试验默示许可,适应症为局部晚期或转移性胃或胃食管交界处腺癌,这是应世生物成立以来在中国获得的首个临床批件。IN10018片是应世生物从勃林格殷格翰(BI)引进的一款黏着斑激酶(FAK)抑制剂,今年8月该药刚在美国获得临床试验许可(IND)。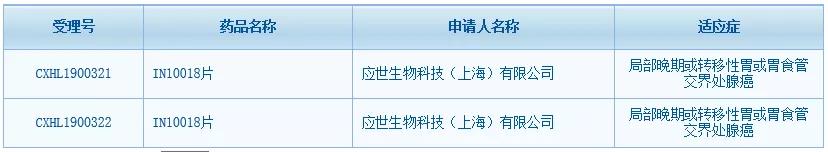
IN10018是勃林格殷格翰开发的一款FAK抑制剂,应世生物现在拥有该药的全球开发和商业化权利。FAK在许多对肿瘤发展至关重要的细胞功能如粘附、迁移、增殖和免疫逃逸中都起作用,FAK抑制剂可通过癌细胞或免疫介导作用来抑制肿瘤生长和转移。临床前研究表明,IN10018能显著提高化疗、放疗、靶向药物、以及免疫治疗的疗效,形成协同效应,克服耐药,有望成为诸多治疗药物的最佳联合治疗药物。2019年8月30日,IN10018在美国获得临床试验许可(IND),这是应世生物首个获得FDA临床试验许可的创新药。10月12日,应世生物宣布与罗氏制药达成一项全球范围内的临床试验合作,对IN10018与罗氏旗下的小分子MEK抑制剂cobimetinib展开联合用药临床研究,以评估联合疗法在葡萄膜黑色素瘤癌症患者中的安全性、耐受性、以及抗肿瘤疗效。根据应世生物官网公开信息,IN10018是应世生物产品管线中进展最快的药物。该药正在与靶向药物、化疗、免疫疗法、放疗开展联合研究,在黑色素瘤、卵巢癌、胃癌、胰腺癌和非小细胞肺癌中的研究已进入1期临床阶段。

应世生物由王在琪博士于2018年12月创立,王在琪博士曾在罗氏、默沙东、礼来等公司任职,拥有20年丰富的临床开发经验,并负责过Keytruda与Gardasil的中国临床试验与注册上市。

以疾病生物学为创新源头,应世生物致力于打造“最佳联合用药研发策略”,建立具备快速临床转化与概念验证能力的平台,成为一家在新药研发2.0时代立足于中国服务全球新药研发公司。目前该公司已经完成数千万美元的A轮融资。除了IN10018外,该公司的产品线还包括一款针对肝癌和结直肠癌的候选药物IN10126,目前正处于IND准备阶段,以及一款正处于探索阶段的候选药物IN30101。我们祝贺应世生物FAK抑制剂IN10018片在中国获得临床试验默示许可,希望该药的临床试验并顺利开展并取得好的结果,为患者带来更多的治疗选择。





