NASH(nonalcoholic steatohepatitis),即非酒精性脂肪性肝炎,也称代谢性脂肪性肝炎,是病理变化与酒精性肝炎相似但无过量饮酒史的临床综合征,与肥胖、胰岛素抵抗、2型糖尿病、高脂血症等代谢紊乱关系密切,其主要特征为肝细胞大泡性脂肪变性伴随肝细胞损伤和炎症,严重者可发展为肝硬化,目前还没有获批疗法。在过去20年里,其前驱疾病非酒精性脂肪性肝病(NAFLD)的发病率已翻倍,成为导致发达国家和地区人们患慢性肝病及肝酶异常的首要原因。据统计,全球约有3-5%的人患有NASH,而且据《自然》杂志2017年的一篇文章,NASH即将成为继慢性丙型肝炎之后美国肝移植的第一大常见原因。
这是一个巨大的未被满足的临床需求。由于对NASH发病机制不明确等各种原因,虽然众多企业纷纷布局该领域,但目前还没有任何治疗NASH的药物获批。不过在过去的一年里,该领域频频传来相关消息。下面笔者将从(1)临床开发/产品上市进展:成功的/失利的(2)公司项目合作/融资/IPO(3)FDA、NMPA监管三个方面进行信息的简单汇总,供朋友们参考。欢迎批评指正!
临床开发/产品上市进展:成功的/失利的
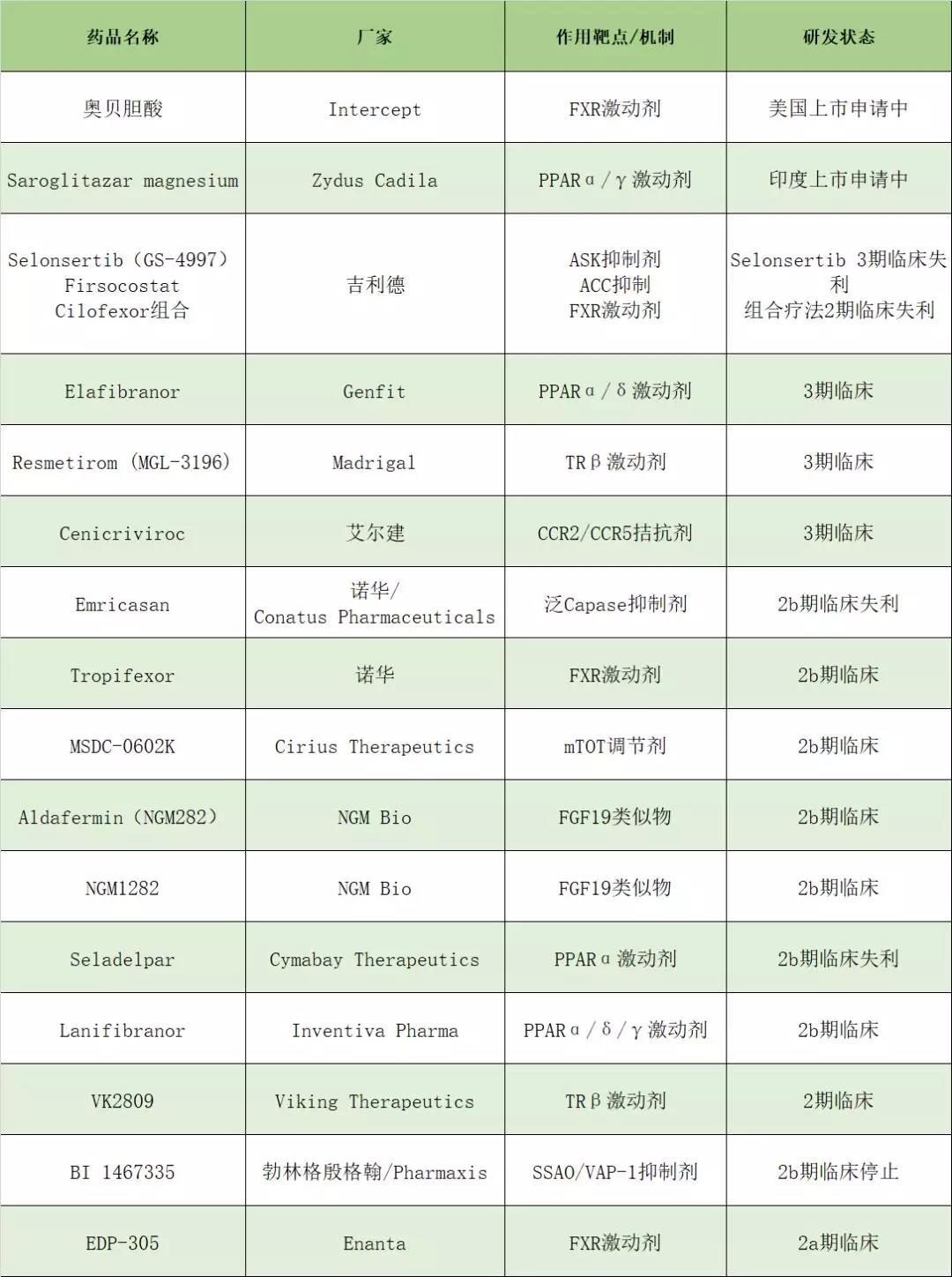
2019年可谓是NASH研发关键年,国内外多款药物在NASH治疗方面取得进展,其中最引人瞩目的当属Intercept公司的奥贝胆酸,已处于上市申请阶段,有望成为FDA批准的第一款治疗NASH肝纤维化药物,而肝病领域的霸主吉利德在过去的一年里却接连遇挫。接下来笔者将为大家盘点2019年NASH领域部分药物的研发动态。
全球NASH药品研发动态
奥贝胆酸(Obeticholic acid,OCA,商品名Ocaliva),是Intercept公司开发的一款法尼酯X受体(FXR)激动剂,曾于2016年5月被FDA有条件加速批准用于治疗原发性胆汁性胆管炎,且被FDA授予治疗NASH肝纤维化突破性药物资格。2019年2月,Intercept公布了奥贝胆酸治疗NASH三期临床研究的期中分析结果(接受奥贝胆酸治疗的患者中23.1%患者的肝纤维化水平改善超过一级,而对照组为11.9%;13.3%患者的肝纤维化水平改善超过2级,约为对照组的3倍),并据此结果Intercept于2019年9月向FDA提交了奥贝胆酸治疗NASH肝纤维化的新药申请(NDA)。同年11月,FDA受理了该申请,并授予优先审查资格,且指定该NDA的处方药用户收费法(PDUFA)目标日期为2020年3月26日,预计今年第一季度将会获批,有望成为第一款被FDA批准用于治疗NASH肝纤维化的药物。Saroglitazar magnesium是由Zydus Cadila开发的一种过氧化物酶体增殖物活化受体(PPAR)激动剂,具有调节PPARα和PPARγ活性的功能,最早于2013年9月在印度上市,用于治疗高甘油三酯血症和未被他汀类药物控制二型糖尿病患者的糖尿病血脂异常。2019年10月,Zydus Cadila宣布其治疗NASH和NAFLD的二期临床试验EVIDENCES IV达到主要终点——与安慰剂组相比,Saroglitazar magnesium使患者的ALT水平下降了44.39%,且通过MRI-PDFF定量评价,患者的肝脂肪含量也达到了统计学意义上的显著降低。2019年12月,Zydus Cadila向印度药品监督管理局提交了Saroglitazar magnesium治疗NASH的新药申请(NDA)。此外,Saroglitazar magnesium还被开发用于治疗多囊卵巢综合症、原发性胆管性胆管炎和糖尿病等疾病。Selonsertib(GS-4997)是吉利德开发的一款细胞凋亡信号调节激酶1(ASK)抑制剂,2019年,Selonsertib治疗NASH的两项三期临床STELLAR-4和STELLAR-3却惨遭滑铁卢。这是继在治疗肺动脉高压(PAH)和糖尿病性肾病(DKD)的二期临床研究失败后,Selonsertib在适应证开发方面再次惨遭失败。2019年12月中旬,吉利德再次宣布一项名为ATLAS的NASH二期临床研究失败,错过该试验一级终点。而该研究旨在比较Firsocostat、Cilofexor、二者双药组合以及二者分别与Selonsertib组合与安慰剂对改善纤维化的影响。不过吉利德另一款潜在NASH药物GS-9674治疗原发性硬化性胆管炎的二期临床在2019年取得了积极结果——明显改善患者的肝脏生化和胆汁淤积的标志物。Elafibranor(GFT505)是一款PPARα/δ激动剂,可以改善胰岛素敏感性、调节血糖平衡、脂质代谢以及减少炎症反应。在针对无肝硬化成人NASH患者的2b期试验中,与安慰剂相比,接受120 mg/d Elafibranor治疗52周的患者可出现NASH的改善。目前正在进行一项3期临床试验,评估120 mg/d治疗72周后,NASH改善的情况,并进行长期随访,以评估相关并发症的进展,目前还无相关数据发布。Resmetirom(MGL-3196)是由Madrigal研发的一款肝靶向、选择性甲状腺激素受体-β(TRβ)激动剂,通过增加肝脏脂肪代谢和降低脂肪毒性来改善NASH。2019年3月,Madrigal 宣布开展Resmetirom治疗NASH的三期临床研究,计划招募约2000位2、3期纤维化的NASH患者,旨在比较使用一年80mg、100mg两个剂量Resmetirom与安慰剂对NASH影响,且其中前900位患者数据将作为加速审批申请依据。此外2019年11月11日柳叶刀公布了Resmetirom治疗NASH的二期临床结果——与安慰剂组相比,Resmetirom 组患者,在12周(Resmetirom vs安慰剂:-32.9% vs -10.4%)和36周(-37.3% vs -8.5%),肝脏脂肪相对减少更为显著。Cenicriviroc是艾尔建开发的一种口服趋化因子受体CCR2/CCR5拮抗剂,于2015 年被美国FDA授予改善 NASH 和肝纤维化的快速通道审评资格。在2019年举办的第28届亚太肝病学会年会上,Tacke团队报到了Cenicriviroc治疗成人NASH和肝纤维化的2b临床研究(CENTAUR)的结果——Cenicriviroc耐受性良好,治疗1年后,相较于安慰剂组,绝大部分的受试者肝纤维化改善≥1期,没有出现脂肪性肝炎的恶化,对那些处于较高疾病活动度和疾病分期的患者治疗获益更为显著。目前该药物已处于3期临床试验。Emricasan是一种首创的、具有口服活性的、泛caspase蛋白酶抑制剂,能够降低介导炎症和细胞死亡或凋亡的酶活性,通过降低这些酶的活性,Emricasan有可能中断引起脂肪肝疾病恶化的炎症和细胞死亡过程,从而中断疾病进展。6月25日,诺华(Novartis)与合作伙伴Conatus Pharmaceuticals联合宣布,评估Emricasan治疗NASH 2b期研究未能达到纤维化、门脉高压和综合临床终点。目前,公司停止对登记患者的进一步治疗。诺华另外一款FXR受体激动剂Tropifexor目前处于2b期临床,且在临床试验中目前未观察到瘙痒副作用的出现。MSDC-0602K是由Cirius Therapeutics开发的一款噻唑烷二酮类胰岛素增敏剂,在今年奥地利维也纳举行的国际肝脏大会上,Cirius Therapeutics公布了MSDC-0602K治疗NASH的2b期临床研究EMMINENCE 6个月的中期数据分析结果——与基线相比,MSDC-0602K组患者在肝功能和胰岛素抵抗方面有着显著改善,且在患有2型糖尿病的患者中,所有MSDC-0602K剂量组都显示了对血糖控制的标志物之一糖化血红蛋白(HbA1c)水平的显著改善。此外,2019年11月, Cirius Therapeutics公司公布了2b期试验EMMINENCE的完整结果,数据显示,MSDC-0602K显著改善了患者的肝脏酶水平,血糖控制和胰岛素抵抗现象。Aldafermin(NGM282)是NGM Bio公司开发的一款成纤维细胞生长因子19(FGF19)的非肿瘤原性的蛋白质工程变异体,可有效抑制新胆酸合成,同时消除FGF19相关的肿瘤原性。最新的二期临床研究数据表明,使用 NGM282 治疗仅12 周(每天一次皮下注射)后,就观察到重大和显著的组织病理学改善,且在12周停止治疗后6周,对于通过活检确诊的NASH患者,NGM282对肝脂肪变性、炎症和纤维化,仍有持续的疗效。此外,一个额外增加的扩张研究队列正在进行, 用以评估NGM282(1mg)在24周时对NASH患者组织病理学参数的影响。而且 NGM公司已开始对处于F2/F3纤维化级别的NASH 患者进行24周、双盲、安慰剂对照的临床2b研究, 评估另两个剂量(0.3和3 mg)的治疗效果。此外该公司另一款NASH药物NGM1282,目前正在进行一个更大规模的2b期研究。VK2809是Viking Therapeutics公司开发的一款特异性TRβ激动剂,2019年国际肝脏大会公布了其治疗LDL-C水平升高的NAFLD的二期临床研究结果——VK2809达到了临床主要终点和关键性次要终点,显著降低患者的LDL-C水平和肝脏脂肪水平。Seladelpar是由Cymabay Therapeutics开发的一款PPARδ激动剂,2019年6月份, CymaBay宣布Seladelpar治疗NASH2b期临床试验没有达到主要终点,其临床收益劣于安慰剂。这一消息导致Cymabay股价腰斩不过虽然Seladelpar在该2b期临床中期研究中降脂效果与安慰剂组无异,但是其对肝损伤标志物的下调效果显著且具有临床意义。Cymabay也不放弃药物,对该药物在2b期临床研究中26周和52 周的表现仍心存期待。Lanifibranor是Inventiva Pharma研发的一款泛PPAR激活剂,2019年2月,其治疗系统性硬化症的2期临床试验FASST错过主要终点。目前,Inventiva已经停止了lanifibranor治疗系统性硬化症的研究,但仍将继续开发Lanifibranor治疗NASH的研究。BI 1467335是勃林格殷格翰于2015年斥资2.5亿美元从Pharmaxis手中购买的一款口服含铜胺氧化酶3抑制剂(AOC3),曾被FDA授予治疗NASH的快速通道资格。然而2019年12月 ,勃林格殷格翰和合作伙伴Pharmaxis宣布SSAO/VAP-1抑制剂BI 1467335在最新的临床研究中虽然没有直接失败,但由于该药与其他药物发生相互作用,双方决定放弃该药用于治疗脂肪肝疾病的研发,眼科适应症方面的开发继续。EDP-305是Enanta公司开发的一款FXR激动剂,2019年9月其治疗NASH的2a期研究ARGON-1取得成功,数据显示EDP-305不仅可以降低患者体内ALT水平,还可以减少患者肝脏脂肪含量。Enanta计划于2020年上半年启动一项名为ARGON-2的72周2b期研究。
近年来,国内多家企业开始布局NASH领域,截止目前,大约有10家公司的12款在研产品获批临床试验。
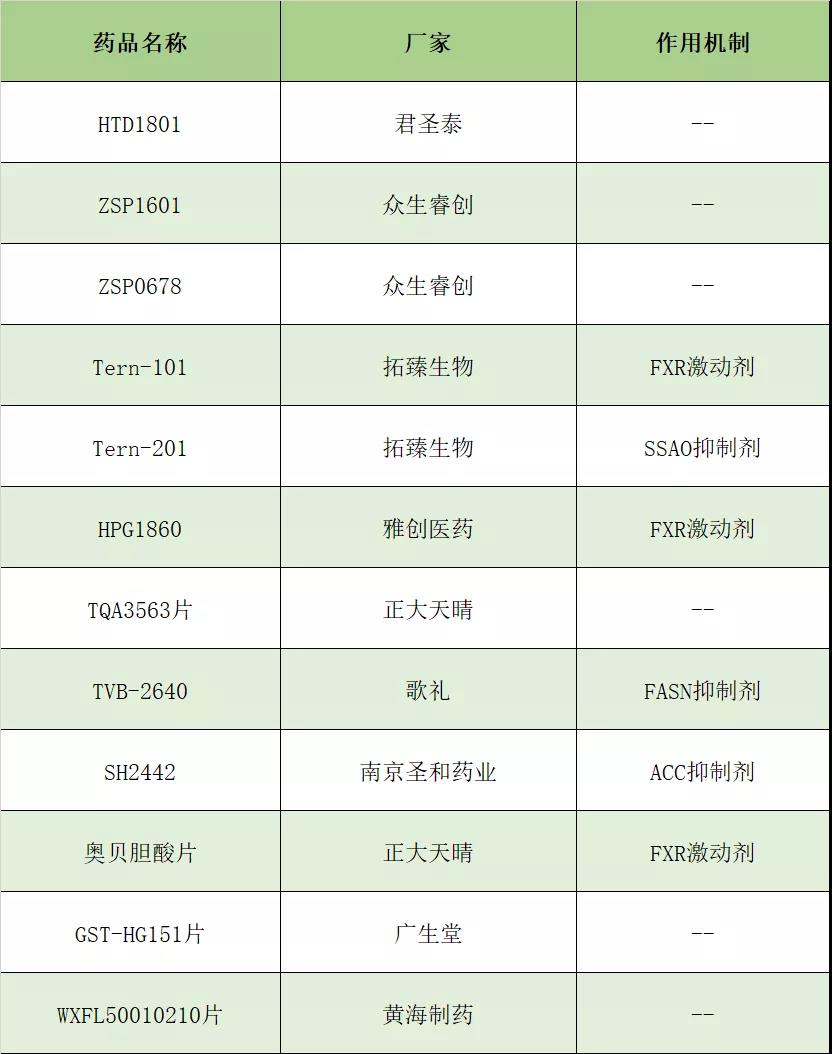
HTD1801是君圣泰开发的一款口服多功能小分子药物,被开发用于治疗NASH和PSC(原发性硬化性胆管炎),且在这两项适应症上均获得了美国FDA的快速通道资格, PSC还获得美国FDA授予的孤儿药资格。在2019年11月8日举行的美国肝病年会上,HTD1801在恒河猴自发性脂肪肝模型中的临床前研究入选主会场口头报告。目前,HTD1801在美国进行的NASH临床二期临床试验患者入组完毕。在国内,已于2019年10月被批准临床,适应症是PSC。
ZSP1601是广东众生睿创开发的国内首个获批临床并具有全新作用机制和全球自主知识产权的用于治疗NASH的一类创新药物,属于First-in-class药物。临床前研究中,不同的动物模型显示,ZSP1601在改善肝组织炎症、血样变性和坏死,以及改善纤维化方面,优于对照产品。并且,该产品有着强大的抗纤维化作用,安全性和耐受性方面的表现理想。同时,ZSP1601片也是首个完成健康人药代及安全性临床试验的用于治疗NASH的国内创新药项目,目前已计划启动临床Ib/Ⅱa试验。此外,用于治疗NASH的ZSP0678片已取得临床试验通知书。Tern-101是由礼来研发的一款FXR激动剂,2018年拓臻生物宣布与礼来签订开发、制造和商业化TERN-101的全球独家协议,在今年国际肝脏大会上,拓臻生物公布了TERN-101临床前研究数据,显示其在饮食诱导的NASH小鼠模型中显著降低肝细胞脂肪变性、炎症、气球样病变和纤维化。目前正在进行一项3期临床试验,评估120mg/d治疗72周的效果,NASH缓解、无纤维化恶化为主要终点;纤维化改善一级、无NASH恶化为次要终点,并进行长期随访,观察临床终点事件,包括肝硬化失代偿、肝移植、肝癌及肝病相关的全因死亡。在国内其针对NASH适应症的临床试验申请于2019年7月被NMPA批准。Tern-201是SSAO抑制剂,目前国内临床试验也已经获批。HPG1860是雅创医药自主研发的一款FXR激动剂,2019年9月,获得美国FDA临床研究许可,一个月后美国一期临床研究启动。TQA3563片由正大天晴研发,作用靶点还未公开,2019年6月获得国家药品监督管理局药品审评中心临床试验默示许可,拟用于NASH治疗。根据药物临床试验登记与信息公示平台,目前该药正在开展一项在健康受试者中耐受性和药代动力学的1a期临床试验(登记号CTR20182250),计划入组70例受试者。TVB-2640(ASC40)是一种全球首创的口服脂肪酸合成酶(FASN)抑制剂,今年2月歌礼与3-V Biosciences达成战略合作,获得该药及相关化合物在大中华区开发、制造和商业化的独家权益,目前已进入国际多中心2期临床试验,2019年4月在美国完成首例NASH患者给药。在国内,2019年8月,NMPA批准TVB-2640的国际多中心临床试验。SH2442,产品名贝诺司他,是南京圣和药业研发的一款ACC小分子抑制剂,2019年CDE受理其临床试验申请,这意味着SH2442是国内首款申报临床试验的ACC靶点创新药。奥贝胆酸是Intercept研发的一种法尼酯X受体特异性激动剂,但据新药研发监测数据库(CPM)显示,国内目前除正大天晴申报上市外,无奥贝胆酸原研和仿制药的注册信息。2019年6月,CDE受理了正大天晴「奥贝胆酸片」的上市申请。而且值得一提的是,恒瑞奥贝胆酸仿制早在2017年7月27日便进行了BE实验,但迟迟没有申报仿制上市,而正大天晴的BE实验虽晚于恒瑞,于2018年8月21日开始,但却反超恒瑞进行仿制申报上市。虽然该药上市申请的适应症是原发性胆汁性胆管炎,但恒瑞和正大天晴更加看中的是奥贝胆酸在治疗NASH方面的优秀表现。
除了上述提到的NASH药品研发动态,2019年多家企业为了布局NASH领域或者为了加速NASH药物的研发进度等目的,与其它公司达成战略合作,下面本文按时间顺序一一列举(如有遗漏,欢迎在评论区补充)。
- 2019年1月,默沙东(MSD)和NGM Bio公司联合宣布,默沙东获得NGM公司开发的NGM313的独家研发权益。而NGM313是一种激活β-Klotho/FGFR1c受体复合体的在研单克隆抗体,目前被开发用于治疗NASH和2型糖尿病。
2019年1月,吉利德与Yuhan以8亿美元达成合作协议,共同开发用于治疗NASH所致晚期纤维化的新治疗方案。
2019年2月,歌礼与3-V Biosciences达成战略合作及融资,歌礼获得ASC40(TVB-2640)及相关化合物在大中华区开发、制造和商业化的独家权益,3-V Biosciences完成1800万美元的E轮第一期融资,由歌礼领投,前海方舟(开曼)投资有限公司、New Enterprise Associates, Inc. (NEA)、和Kleiner Perkins (KP)跟投。
2019年2月,先为达生物完成A轮近2亿人民币的融资,由君联资本领投,老股东拾玉资本和凯因科技跟投。
2019年3月, Genfit宣布将在纳斯达克上市,融资约1亿美元,发现和开发针对肝脏疾病的候选药物和诊断解决方案。
2019年3月,景凯生技宣布将旗下的NASH新药JKB-122、JKB-133的亚洲市场权利独家授予恒翼医药(上海)公司。
2019年3月,NGM Bio向美国证券交易委员会递交了IPO申请,拟募资1亿美元。
2019年4月,吉利德与insitro公司达成战略研发合作,共同发现和开发治疗NASH的创新疗法。且同月与诺和诺德达成NASH领域合作,探索索马鲁肽联合cilofexor、firsocostat 治疗NASH的效果。
2019年5月,杏泽资本完成对雅创医药千万美元级别的投资。
2019年5月,比利时干细胞疗法开发公司Promethera Biosciences完成3970万欧元的融资,用于加速慢加急性肝衰竭(ACLF)和NASH细胞治疗的临床开发。
2019年6月,Genfit宣布与拓臻生物签署许可和合作协议,拓臻生物获得elabibranor在大中华地区治疗NASH和PBC的独家开发和推广权益,此外双方还将在肝病领域开展联合研发项目,包括将elafibranor与拓臻生物的在研化合物构成组合疗法。Elafibranor是一款口服PPARα/δ激动剂,其NASH和PBC两个适应症均获得FDA突破性进展授权。
2019年7月,吉利德科学和Renown Institute for Health Innovation(IHI)宣布,双方达成战略合作,通过收集和分析大型基因和电子健康数据来加强对NASH的理解,为发展NASH疗法提供更多信息。
2019年7月,勃林格殷格翰(BI)宣布以4000万美元首付、8.3亿潜在里程金与Yuhan公司合作开发用于治疗NASH及相关肝病的同类首个双激动剂,该双激动剂在一个分子中结合GLP-1和FGF21的双重活性。
2019年8月,3-V Biosciences宣布已更名为Sagimet Biosciences,完成E轮第二期700万美元融资,至此E轮共融资2500万美元。
- 2019年8月,众生睿创增资扩股,此次交易是根据众生睿创A轮融资约定实施的A轮融资后续跟投事项。众生睿创此次增资扩股由境外投资者BioTrack Capital Fund I, LP以美元全额认缴本次新增注册资本,出资完成后,BioTrack Capital Fund I, LP将持有众生睿创4.20%的股份。截至目前,众生睿创已成功引进A 轮战略投资者,累计引入外部资金2000万美元,对应新增注册资本2500万元人民币。
2019年8月,D&D Pharmatech完成B轮1.37亿美元融资,由Octave Life Sciences和韩国风险投资基金Smilegate Investment联合领投,推进神经退行性疾病、NASH创新疗法的开发。
2019年10月,吉利德宣布与Glympse Bio公司达成战略协议,合作进行NASH的临床开发。
2019年10月,致力于开发纤维化疾病新疗法的生物医药公司Pl Pliant Therapeutics宣布与诺华达成一项战略性研发合作协议,双方共同开发αvβ1整合素(integrin)抑制剂PLN-1474和其它三款整合素候选产品。其中PLN-1474是由Pliant公司开发用于治疗NASH引起肝纤维化的临床前候选药物。
2019年11月,诺和诺德从日本UBE Industries引进了UD-014,一个SSAO/VAP-1小分子抑制剂,用于NASH和其它适应症的开发。
2019年12月,致力于开发干细胞疗法的Promethera Biosciences公司宣布完成4720万欧元的D轮融资,以推进其干细胞疗法HepaStem在治疗NASH和ACLF中的临床开发。
各个国家的监管机构为了指导、促进NASH药物研发,也出台了相应的政策。
美国FDA在2018年12月出台一份NASH研发指南草案(涵盖从动物模型的选择,到后期临床试验的规划等一系列内容),2019年6月又发布了另一份侧重3期临床试验的患者招募、临床终点、以及安全性考量的草案。
在国内,为指导和规范非酒精性脂肪性肝炎治疗药物临床试验,国家药品监督管理局于2019年12月组织制定了《非酒精性脂肪性肝炎治疗药物临床试验指导原则(试行)》。