3月12日,强生集团在华制药子公司西安杨森宣布,乌司奴单抗(商品名:喜达诺)在中国获批一项新适应症:治疗对传统治疗或肿瘤坏死因子a(TNFa)拮抗剂应答不足、失应答或无法耐受的成年中重度活动性克罗恩病(CD)患者。
乌司奴单抗是一种全人源单克隆抗体,已在89个国家获批,并获得过加拿大盖伦“创新产品奖”(2010年)、美国盖伦“最佳生物技术产品奖(2011年)”和国际盖伦奖(2012年)。乌司奴单抗能获得这么多的殊荣,要归功于它作用的两个靶点IL-12、IL-23。那么IL-12、IL-23是什么?它们有何作用?除了乌司奴单抗外,靶向这两个靶点的药物还有哪些?
L-12全称为细胞因子白细胞介素12,在小鼠和人类中,IL-12由与IL-12p35亚基连接的IL-12p40亚基组成,这个异二聚体通过IL-12受体(IL-12R)传递信号。IL-12可刺激非受体Janus激酶2(JAK2)和酪氨酸激酶2(TYK2)活性,导致信号转导子和转录激活子(STAT)家族成员STAT1、STAT3、STAT5,尤其是STAT4同型二聚体磷酸化。IL-23全称为细胞因子白细胞介素23,它由两个亚基组成,一个是与IL-12共享的p40亚基(IL-12 / 23p40)外,另外一个是IL-23p19亚基,它们通过IL-23R和IL-12Rβ1传递信号。与IL-12一样,IL-23激活JAK和STAT信号分子,但主要激活STAT3。
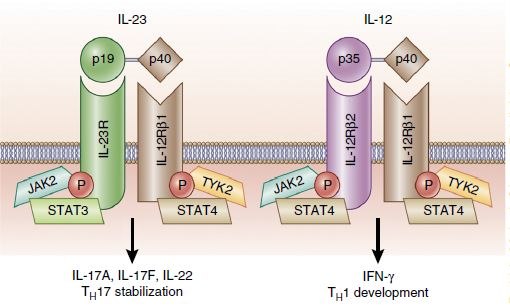
IL-12和IL-23及其受体和下游信号通路的示意图(图片来源:参考资料[1] )
在人体中,IL-12和IL-23由组织中的“预警细胞”生成,它们包括树突状细胞和巨噬细胞。IL-12和IL-27的共同作用,会导致CD4+ 辅助T细胞(Th)分化为表达干扰素γ(IFNγ)的Th1细胞。而IL-23与其它细胞因子共同作用,能够将CD4+ Th细胞分化为Th17细胞。IL-23同时刺激Th17细胞分泌IL-17家族的细胞因子,IL-23还能够刺激其他类型细胞释放IL-17家族细胞因子。IL-17家族的细胞因子具有促炎症的作用。急性炎症反应是身体对抗外来病原体入侵的正常反应,然而当体内促炎症细胞因子和抑制炎症细胞因子的水平失衡时,会导致炎症持续发生,导致风湿性关节炎、炎症性肠病(IBD,通常包括克罗恩病和溃疡性肠炎)、脊柱关节炎(SpA)和银屑病等慢性炎症性疾病。基于IL-12、IL-23/IL-17信号通路在释放促炎症细胞因子方面的关键性作用,这一信号通路也成为医药公司治疗慢性炎症疾病的热门靶标,催生了多款重磅疗法和在研疗法。
1、药品名称:乌司奴单抗(ustekinumab)乌司奴单抗是强生旗下杨森制药开发的一款IL-12和IL-23拮抗剂,可特异性结合白细胞介素IL-12和IL-23的p40蛋白亚单位,亲和力高。自2009年9月首次获批上市以来,乌司奴单抗已经先后在美国获批了五个适应症,分别为中重度斑块状银屑病成人患、活动性银屑病关节炎成人患者、中重度活动性克罗恩病(CD)成人患者、以及中重度活动性溃疡性结肠炎成人患者。

在中国,乌司奴单抗注射液于2017年11月首次获批,用于治疗中重度斑块状银屑病,是中国国内获批的首个全人源“双靶向”IL-12和IL-23抑制剂。2019年5月,乌司奴单抗在中国被加入到第二批临床急需境外新药名单中。本次获批的克罗恩病适应症是其在中国获批的第二个适应症。
AK101是康方生物自主开发的抗IL-12/IL-23单克隆抗体注射液,康方生物拥有完全自主知识产权和全球权利。AK101通过阻断细胞因子IL-12和IL-23的生物学活性,以达到临床治疗自身免疫性疾病的作用。根据康方生物官网,AK101目前正在中国开展针对中重度斑块状银屑病、中重度溃疡性结肠炎、系统性红斑狼疮适应症的研究,同时还在美国开展针对中重度溃疡性结肠炎的研究。

目前,AK101进展最快的是在中国开展的针对中重度斑块状银屑病的研究,已进入到2期临床阶段。针对其它适应症的研究,尚处于IND申报阶段。CDE网站数据显示,康方生物最近又提交了一项关于AK101的临床试验申请,于2020年2月19日刚获受理。这意味着,AK101将有望在中国开展针对第二个适应症的临床研究。3、药品名称:Tremfya (guselkumab)
Tremfya (guselkumab)是强生旗下杨森制药开放的一款特异性抑制IL-23的单克隆抗体,可通过与IL-23的p19亚基结合,阻断IL-23作用的人源化单克隆抗体。2017年,Tremfya已经获得美国FDA的批准治疗中重度斑块型银屑病成人患者。

2019年11月,杨森制药宣布,Tremfya在治疗活跃性银屑病关节炎成人患者的3期试验中达到主要研究终点,与安慰剂相比,显著改善了患者的ACR20(美国风湿病学会疗法评估指标之一)。目前,杨森公司已经向美国FDA和欧洲EMA递交了Tremfya治疗活跃性银屑病关节炎患者的新适应症申请。
4、药品名称:Skyrizi(risankizumab)Skyrizi(risankizumab)是艾伯维和勃林格殷格翰(Boehringer Ingelheim)共同开发的一款IL-23特异性抑制剂,可通过与IL-23的p19亚基相结合,有选择性地阻断IL-23信号通路。2019年4月,Skyrizi获得美国FDA批准治疗中重度银屑病患者。在临床试验中,Skyrizi能够高度清除皮肤症状,大多数(>80%)接受治疗的患者接受治疗一年后90%皮肤症状消失(PASI 90),超过半数患者皮肤症状完全消失(PASI 100)。

在中国,risankizumab注射液已获得5项临床试验默示许可,针对“6岁及以上青少年和成人中重度溃疡性结肠炎”和“成人活动性银屑病关节炎”两种适应症。5、药品名称:Ilumya(tildrakizumab)公司:默沙东/太阳制药(Sun Pharmaceutical)

Ilumya(tildrakizumab)是默沙东(MSD)和太阳制药公司开发的一款IL-23特异性抗体,可以选择性结合IL-23的p19亚基,并抑制其与IL-23受体作用,从而抑制促炎细胞因子和趋化因子的释放。2018年3月,Ilumya获得美国FDA批准,治疗适合接受全身治疗或光疗的中度至重度斑块型银屑病成人患者。公司:礼来(Eli Lilly and Company)Mirikizumab是礼来公司开发的一款靶向IL-23的p19亚基的全人源化单克隆抗体。目前,礼来公司已经开展多项3期临床试验,评估mirikizumab治疗银屑病、克罗恩病和溃疡性结肠炎的效果。根据礼来在2019年美国消化疾病周(DDW)医学会议上公布的结果,mirikizumab在治疗中重度克罗恩病患者的2期临床试验中获得了积极结果:与安慰剂相比,mirikizumab在治疗12周后显著降低临床和内镜检测到的疾病活动。治疗银屑病的关键性3期临床试验有望在2020年获得结果。

在中国,mirikizumab注射液已获得6项临床试验默示许可,针对中重度活动性溃疡性结肠炎、中重度活动性克罗恩病适应症。此外,礼来产品管线中还有一款靶向IL-23的抑制剂LY-900021,和一款靶向IL-23/CGRP的双抗,目前正在1期临床研究阶段。

Brazikumab是艾尔建公司开发的一款IL-23特异性抗体。Clinicaltrials.gov 网站信息显示,艾尔建正在中重度克罗恩病和溃疡性结肠炎中开展2/3期临床研究,评估brazikumab的安全性和有效性。在中国,Brazikumab无防腐剂溶液已获得两项针对中度至重度活动性克罗恩病的临床试验。公司:Protagonist TherapeuticsPTG-200是Protagonist公司开发的一款靶向IL-23受体的“first-in-class”小分子口服拮抗剂。2017年,Protagonist公司和杨森制药达成合作,共同开发和商业化PTG-200。PTG-200目前已完成1期临床,将进入针对克罗恩病的2期临床研究。2019年5月,Protagonist和杨森制药公司扩大了双方在2017年达成的合作,其中包括合作开发第二代IL-23口服拮抗剂。除了上述药品外,还有一些靶向IL-12、IL-23信号通路的在产品研正在研究之中。我们期待这些新一代免疫疗法能够在更多慢性炎症性疾病中产生效果,惠及更多患者。










