根据世界卫生组织(WHO)的报告,全球新冠病毒病(COVID-19)确诊患者人数已经接近70万人。新冠病毒的广泛扩散意味着征服COVID-19的战“疫”有可能旷日持久。在这种情况下,开发有效的疗法和疫苗,不但是挽救患者生命的关键,也是防范疫情复发,帮助人们恢复日常生活的关键。针对COVID-19的疗法和疫苗研发不但需要产出安全有效的产品,而且需要提供足够的产能,来满足全球性的医疗需求。如何尽快将有效产品送到患者手中,是医药公司和监管机构需要共同解决的问题。下面我们来看一看它们在这方面做出的努力。
强生新冠病毒疫苗9月启动临床试验,2021年初有望用于紧急使用
今日,强生(Johnson & Johnson)公司宣布,已选出其主打新冠病毒候选疫苗。该公司旗下杨森(Janssen)公司将扩展与美国生物医学高级研究与开发局(BARDA)的合作,迅速扩大该公司的制造能力,目标为能够为全球提供超过10亿剂疫苗!杨森公司自今年1月起就开始进行新冠病毒疫苗的研发。使用该公司的腺病毒载体技术平台AdVac,杨森的研究团队与哈佛大学医学院的研究人员联合设计并检测了多种候选病毒疫苗,并且进行了临床前检测。杨森公司对这一技术平台已经进行了长期广泛的研究,它曾经用于开发预防埃博拉病毒和呼吸道合胞病毒(RSV)的疫苗,具有良好的安全性。同时,该公司的Per.C6生产技术能够保证快速、大规模地生产腺病毒载体,从而满足大流行时对疫苗的强劲需求。目前,研究团队已经从中筛选出一款主打候选疫苗和两款备选疫苗,即将开始临床级别生产阶段。强生公司和BARDA联合将承诺投资超过10亿美元,加快新冠病毒疫苗的研发。在加速开发的情况下,强生公司预计这一候选疫苗的临床试验将在2020年9月启动,而且,这款疫苗有可能在2021年初就可以用于紧急使用。

▲杨森传染病与疫苗全球总监Johan Van Joof博士在药明康德线上论坛介绍杨森公司的疫苗开发策略
应对PPE短缺危机,FDA授予创新PPE消毒技术紧急使用授权
由于疫情的广泛扩散,全球范围出现了个人防护设备(PPE)的短缺,这一短缺可能严重影响在一线工作的医务人员保护自己的能力,从而让医疗系统承受更大的压力。
日前,Battelle公司宣布,FDA授予该公司的CCDS重症监护消毒系统(CCDS Critical Care Decontamination System)紧急使用授权(EUA),将用于对使用过的PPE进行消毒,让它们重新可以被医务人员使用。
这一系统通过浓缩气相过氧化氢(vapor phase hydrogen peroxide,VPHP)对PPE进行消毒。每台消毒系统每天能够对80000个N95口罩进行消毒。这一消毒系统可以对一个口罩反复消毒高达20次,且不影响口罩的防护功能。
这一系统的表现在2015年FDA赞助的一项研究中得到证明,在这项研究中,被嗜热链球菌(G. stearothermophilus)沾染的N95口罩,在接受CCDS系统消毒之后,无法检测到嗜热链球菌的存在,并且口罩的过滤功能不受影响。目前,该公司正在进行研究,探索是否其它PPE能够使用这一系统进行消毒。

图片来源:FDA官网
基因疗法递送新冠病毒抗体,Vir Biotechnology与Generation Bio达成合作
今日,Generation Bio和Vir Biotechnology公司宣布,双方达成合作研发协议,使用Generation Bio公司的非病毒基因疗法技术平台,扩展Vir的在研新冠病毒抗体的疗效和使用范围。Generation Bio公司的技术平台有潜力将编码抗体的遗传信息直接送到细胞内部(无需使用腺相关病毒载体),让患者的细胞成为生产抗体的“工厂”。
Generation Bio公司的封闭DNA(close-ended DNA,ceDNA)技术让研究人员能够不使用腺相关病毒载体,使用脂质纳米颗粒(LNP)将转基因递送到患者细胞的细胞核中。在细胞核中ceDNA不会整合到细胞的基因组中,并且能够维持稳定、高水平的蛋白表达。这一技术可能维持蛋白表达长达数年。
Vir已经开发出中和新冠病毒的强力候选抗体。该公司认为,使用这一基因疗法技术可能提供更为广泛和长久的病毒防护能力。
“我们渴望将中和抗体尽快带给患者,如果它们有效,将这些抗体尽快带给尽可能多的患者。我们很高兴能够探索ceDNA在传染病领域的应用潜力。”Vir公司首席执行官George Scangos博士说。

▲Vir公司首席执行官George Scangos博士在药明康德线上论坛分享中和抗体开发的洞见
相关阅读:加速开发抗病毒新药,哪些问题很关键?| 药明康德线上论坛实录
美国FDA授予氯喹类药物紧急使用授权,治疗COVID-19患者
当地时间3月28日,美国FDA发布紧急使用授权(EUA),允许将捐赠给国家战略储备(SNS)的硫酸羟氯喹和磷酸氯喹产品分发并用于某些住院的COVID-19患者。这些药物将从SNS分发至各州,以便在患者无法加入临床试验时,由医生酌情为住院的COVID-19青少年和成人患者使用。
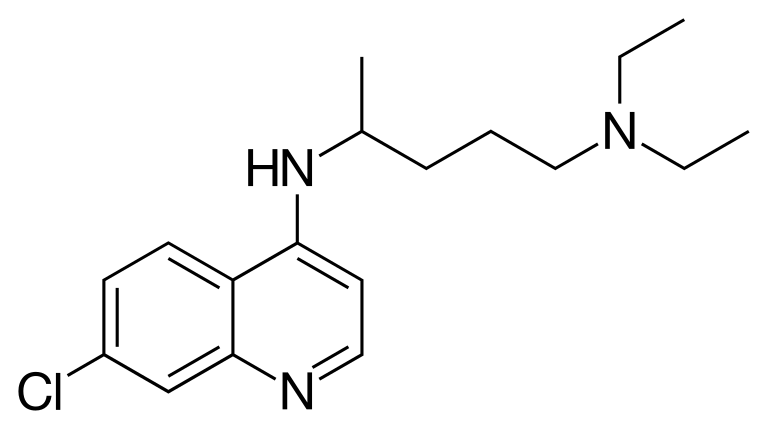
▲氯喹分子结构式(图片来源:Fvasconcellos/Public domain)
氯喹作为一款治疗疟疾和某些炎症性疾病的“老药”,近来获得了广泛关注。它在体外实验中表现出抑制新冠病毒的活性,然而在已经完成的小型临床试验中,治疗COVID-19的疗效并不一致。目前世界卫生组织(WHO)启动的全球性SOLIDARITY临床试验将检验它的疗效。美国纽约州也已经启动大型临床试验,检验它治疗COVID-19患者的效果。






