6月18日,华领医药宣布其首创新药dorzagliatin的首个3期临床试验SEED(也称为HMM0301)的结果。该试验在463名2型糖尿病患者中开展,基于核心数据分析,52周治疗保持了其长期稳定疗效和安全性!“我们对于这一成就感到非常骄傲。在过去的十年中,华领团队与我们的合作伙伴密切协作,共同推进了dorzagliatin的研发,”华领医药首席执行官、创始人陈力博士表示,“随着SEED的成功完成,华领医药成为全球第一家实现葡萄糖激酶激活剂(GKA)临床开发的公司。”Dorzagliatin(HMS5552)是华领医药开发的一款全球首创的双重机制葡萄糖激酶启动剂。它是基于葡萄糖激酶(glucokinase,GK)作为血糖传感器,在血糖稳态调控中发挥核心作用的全球领先科学概念而开发。通过修复成年2型糖尿病患者下降的GK功能,重塑血糖稳态,而实现治疗2型糖尿病。SEED研究在463名2型糖尿病患者中开展,旨在研究患者接受一天两次dorzagliatin 75mg用药治疗的疗效和安全性。该研究前24周为随机双盲、安慰剂对照的疗效和安全性研究,受试者以2:1比例入组,随机接受一天两次口服75mg dorzagliatin或安慰剂的治疗,用以评估dorzagliatin的主要疗效终点和安全性。研究后28周为开放性药物治疗,治疗期间所有患者均接受一天两次口服75mg dorzagliatin进行治疗。2019年11月,华领医药宣布SEED研究在前24周双盲治疗期达到主要疗效和安全性终点。数据显示,dorzagliatin安全且耐受性好,治疗24周期间低血糖发生率低于百分之一,无药物相关的严重不良事件发生。疗效显著,dorzagliatin治疗24周后糖化血红蛋白相对基线降低1.07%,显著优于安慰剂。根据公告,在2020年第80届ADA科学会议上,陈力博士全面地报告了SEED研究在24周双盲安慰剂对照期内的数据。该报告数据表明,除了降低血糖,dorzagliatin治疗组的β细胞功能也有所改善(通过具有临床意义的生物标志物HOMA2-β进行评估),相反,在同一时期内,安慰剂组的β细胞功能则有所下降。
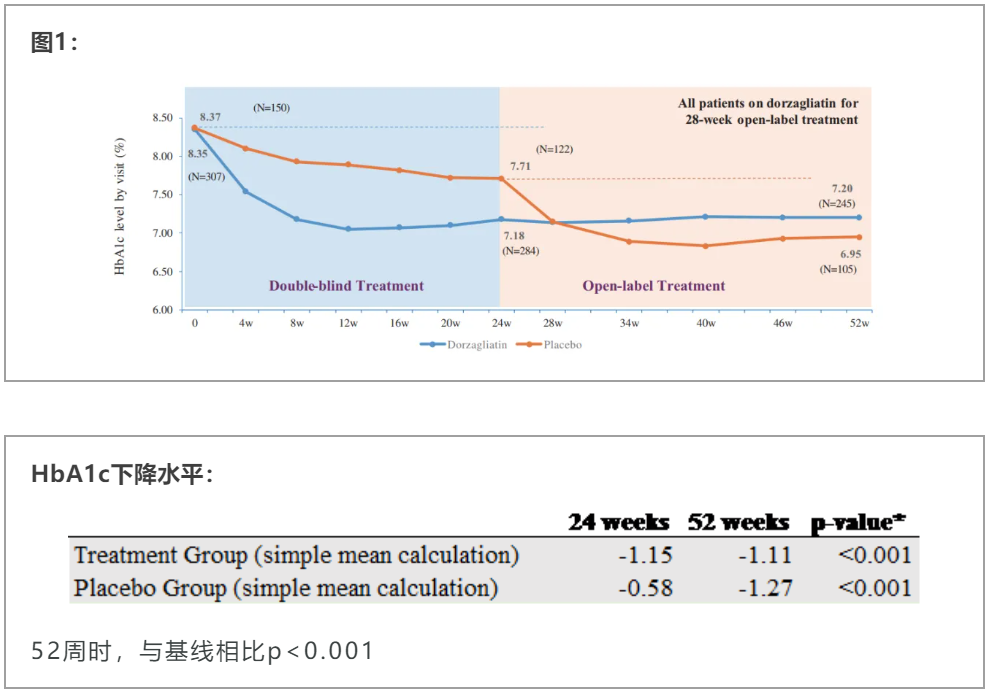
▲52周期间,两个治疗组的关键疗效结果通过糖化血红蛋白(HbA1c)的下降评估(截图来源:华领医药官微)
此次华领医药还公布了SEED研究后28周为开放性治疗的结果。在28周开放性治疗期内,dorzagliatin持续显示出良好的安全性和耐受性,这一结果也得到了安全性分析的验证。Dorzagliatin治疗组与安慰剂组的不良事件发生率相似,52周治疗期间内低血糖(血糖低于<3mmol)发生率低于1%。28周治疗期间,作为2型糖尿病的主要标志,患者的胰岛素抵抗指标持续性降低。基于核心数据分析,52周治疗保持了其长期稳定疗效和安全性!单药疗法之外,华领医药也在探索dorzagliatin与二甲双胍、DPP-4抑制剂、SGLT-2抑制剂、胰岛素、GLP-1受体激动剂等多种2型糖尿病药物联合治疗的潜力,并已取得许多研究进展。其中,dorzagliatin与SGLT-2抑制剂恩格列净在联合治疗其它疗法无法控制的2型糖尿病患者的1期临床研究中已取得积极结果。结果显示,与dorzagliatin联用更好地提升了SGLT-2类药物对2型糖尿病患者血糖的控制效果,进而扩大了糖尿病患者适用人群,并可显著改善患者胰岛功能。该结果在今年4月得以公布。我们祝贺华领医药全球首创2型糖尿病药dorzagliatin在临床研究中取得的这些进展和成果,希望该药早日获批,惠及患者!




