日前,Myovant Sciences公司宣布,该公司为创新疗法relugolix递交的新药申请(NDA)已被美国FDA接受,适应症为男性晚期前列腺癌患者。FDA同时授予这一NDA优先审评资格,预计在今年12月20日之前做出回复。FDA在受理函中还表示,目前不计划为这一申请召开咨询委员会会议。如果获批,relugolix将成为首个也是唯一一个治疗晚期前列腺癌患者的口服促性腺激素释放激素(GnRH)受体拮抗剂。
前列腺癌是世界上男性最常见的第二大癌症。据估计,在2018年,有120万的新患者,同时大约有36万患者因此而去世。前列腺癌是导致男性癌症死亡的第5大原因。对于去势敏感性前列腺癌患者来说,标准治疗方法包括促性腺激素释放激素(GnRH)激动剂醋酸亮丙瑞林(leuprolide acetate)。但这种疗法可能会引起睾丸激素水平的短暂性升高,加剧临床症状,且停药后会延缓睾丸激素水平的恢复。Relugolix是一款口服的GnRH受体拮抗剂,可以结合并阻断垂体前叶中的GnRH受体,减少促黄体生成激素(LH)和卵泡刺激素(FSH)的释放,从而降低女性卵巢生成的雌激素水平和男性睾丸激素的产生。Myovant Sciences正在开发治疗晚期前列腺癌的relugolix单药片剂和治疗子宫肌瘤的relugolix组合片剂。今年5月,Myovant Sciences已经递交relugolix组合片剂治疗子宫肌瘤的新药申请。
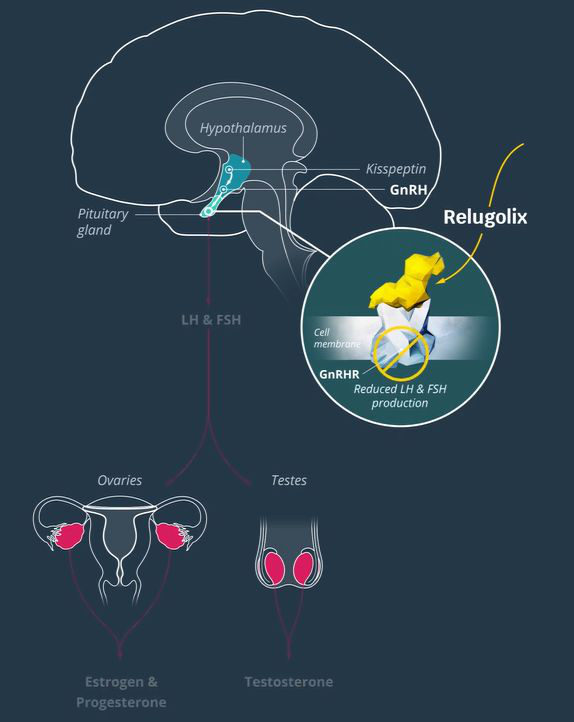
▲Relugolix的作用机制示意图(图片来源:Myovant Sciences官网)
这一申请获得一项随机、开放标签、平行组3期临床试验数据的支持。总计900多名雄激素敏感性晚期前列腺癌男性患者接受了relugolix或醋酸亮丙瑞林的治疗。试验结果表明,relugolix达到了主要疗效终点,接受relugolix治疗的男性中96.7%在48周内睾酮持续抑制水平达到去势水平(<50 ng/dL),而接受醋酸亮丙瑞林治疗的男性中88.8%达到这一水平。在安全性方面,与醋酸亮丙瑞林组男性相比,relugolix组男性发生主要不良心血管事件(MACE)的风险降低54%。在报告有MACE病史的男性中,relugolix组报告的MACE事件比醋酸亮丙瑞林组少80%(分别为3.6%和17.8%)。Myovant Sciences公司首席执行官Lynn Seely博士说:“我们很高兴FDA接受了我们为relugolix递交的新药申请,并且授予其优先审评资格。这使我们离为晚期前列腺癌患者提供每日一次的口服新治疗选择又进了一步。”
参考资料:
[1] Myovant Sciences Announces Priority Review and FDA Acceptance of New Drug Application for Once-Daily, Oral Relugolix for Advanced Prostate Cancer. Retrieved June 22, 2020, from https://investors.myovant.com/news-releases/news-release-details/myovant-sciences-announces-priority-review-and-fda-acceptance/


