宫颈癌是最常见的妇科肿瘤之一,其治疗早期以根治性手术为主,晚期以放射治疗为主。随着新的化疗药物和化学治疗途径的出现,同期放疗、化疗已成为中晚期宫颈癌中的标准治疗方案,但局部的复发仍较高。约29%~38%的宫颈癌患者在治疗后复发,因此,复发性宫颈癌成为临床关注的重点。复发性宫颈癌的化疗选择非常有限,大多数复发性宫颈癌病例均无法治愈。根据妇科肿瘤组(GOG)的评估,复发或转移性宫颈癌的最佳方案是联合顺铂、紫杉醇和贝伐单抗,总响应率(RR)为48%,中位生存期为17个月。然而,由于该组患者预后不佳,二线化疗对复发性宫颈癌的益处尚未达成共识。
免疫疗法是一种新的治疗癌症的方法,它依赖于免疫系统对肿瘤细胞的直接识别和杀伤能力。最初的观察结果表明,颈部恶性肿瘤在感染后会有显著反应,这一发现首次表明了免疫疗法在癌症治疗中的作用。从那时起,人们开发了提高对癌症免疫反应的疗法,现在已经被批准用于治疗许多癌症。
几乎所有的宫颈癌都是人类乳头状瘤病毒(HPV)感染的结果。上皮损伤后,HPV可感染角质形成细胞的基底细胞层。对大多数人来说,这种感染可以被彻底清除。然而,高危型HPV(如16型和18型)更有可能持续存在并整合到宿主基因组中,从而导致癌蛋白E6和E7的过度表达。这些癌蛋白通过下调关键途径(如干扰素生成、刺激途径和Ⅰ类主要组织相容性复合体(MHC)分子表达HPV抗原等)干扰自然免疫应答。HPV感染也会损害郎格汉斯细胞的功能,这是免疫反应的关键。然而,宫颈癌中残留的病毒抗原使免疫治疗成为一种有吸引力的治疗选择,因为这些抗原可以被识别为外来抗原。尽管通过阻断程序性死亡受体-1(PD-1)的检查点抑制已成为宫颈癌试验的主要药物,但其他几种免疫治疗策略目前仍在开发中。
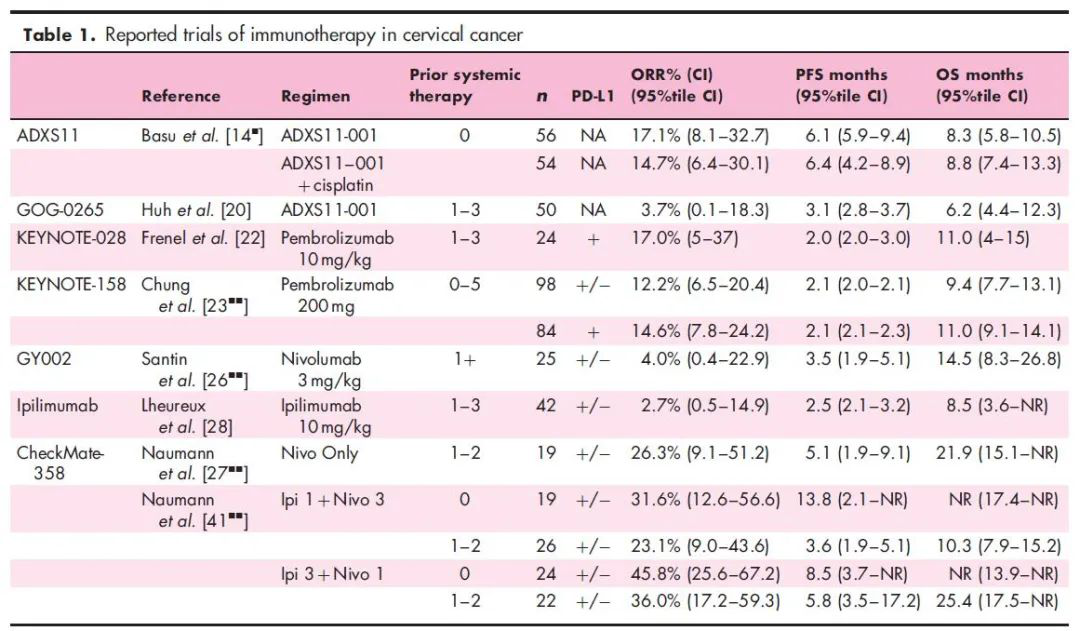
表1:来源参考文献1
预防性HPV疫苗目前已得到批准,在预防HPV感染方面非常有效,但在清除已建立的HPV感染方面似乎无效。针对宫颈发育不良和宫颈癌的新型治疗性疫苗的研究正在进行中。一项利用假单胞菌外毒素-HPV16 E70KDEL3融合蛋白或TVGV-1与两种不同佐剂结合的临床前试验在小鼠模型中显示了初步的有效结果,这与延长HPV16 E7特异性CD8+T细胞的存活期和增殖有关。另外,治疗性疫苗pNGVL4a-CRT/E7也已有了初步结果,针对CIN2/3级继发HPV16的患者。该疫苗由一个DNA质粒(pNGVL4a-A)构成,该质粒编码与hpv16型E7抗原脱毒形式相关的钙网蛋白。这种疫苗旨在增加细胞毒性T细胞,以期清除已建立的hpv16感染。在这项首次人类临床试验中,27名妇女接种了疫苗,缓解到CIN 1或更低水平的比率为30%。与对照组相比,细胞毒性T细胞增多。
人们对疫苗与其他免疫治疗方法结合的作用同样也很感兴趣。其中一个新的策略是计划中的VolATIL试验(NCT03946358),该试验将UCPVax疫苗与程序性细胞死亡配体1(PD-L1)抑制剂atezolizumab相结合,在包括47名HPV阳性人类癌症(包括头颈癌、肛门癌和宫颈癌)患者中进行。按照设计,主要终点是4个月时的客观RR,次要终点包括总生存率(OS)、无进展生存率(PFS)和健康相关生活质量。
单核细胞增生李斯特菌是一种革兰氏阳性细菌,可刺激细胞免疫。单增李斯特菌具有独特的特性,包括细胞质复制和缺乏内毒素,使其成为理想的载体。Axalimogene filolisbac或ADXS11-001是通过生物工程技术开发的一种治疗药物,它能分泌一种融合蛋白,该融合蛋白包含一个与人HPV-16E7融合的李斯特溶素O(tLLO)片段。给药后,抗原呈递细胞通过吞噬作用吸收抗原,tLLO-HPV-16E7融合蛋白激活MHC I类通路。此外,通过吞噬作用摄取后,单增李斯特菌分泌的抗原也可以出现在MHC II类通路中。ADXS11-001还可能改变肿瘤微环境,促进T细胞浸润,减少免疫调节细胞的免疫抑制。
在I期试验中,15例转移性宫颈癌患者接受了ADXS11-001(LmLLO-E7)治疗。治疗包括三种不同剂量水平(1Χ109 CFU/ml、3.3Χ109 CFU/ml和1Χ1010 CFU/ml)中的一种在3周内2次疫苗注射,并结合治疗后给予氨苄西林。客观地说,13名可评估患者中有7名(54%)病情稳定,1名患者对治疗有未确认的部分反应(PR)。ADXS11-001在印度的25个中心进行了随机2期试验。这项试验比较了1Χ109 cfu/ml剂量的单独给药和联合40mg/m2顺铂从第29天开始每周5次的效果,试验的主要终点是OS。在这项研究中,共有110名女性被随机分组,两组患者的中位OS相似,ADXS11-001的中位OS为8.3个月(95% CI,5.9-10.5),而联合用药组的OS中位数为8.8个月(95%CI,7.4-13.3)。这项试验的标志性参数12个月生存率为35%(38/109)。GOG还对50名患者进行了单剂ADXS11的两阶段2期试验(GOG-0265)。中位OS为6.2个月(95%CI,4.4-12.3),12个月OS为38%(范围12.0-40.1),比预期生存率提高52%。治疗耐受性好,3级的TRAE仅有贫血。
与pembrolizumab相似,nivolumab是PD-1的抗体。在第II期研究NRG-GY002(NCT022257528)中首次评估了nivolumab对宫颈癌的效果。先前接受过一次全身化疗的转移性或复发性宫颈癌患者,每2周给予3mg/kg的nivolumab,主要终点是PFS。77%的患者表达PD-L1,在可评估疗效的25名患者中,只有一名患者有部分响应,RR为4%(95% CI 0.4–22.9)。尽管RR很小,但该组的中位生存期为14.5个月(95% CI 8.3-26.8)。6个月存活率为78%,12个月时为56%。3级治疗相关不良事件发生率为24%。
CheckMate-358为nivolumab单剂量单臂试验,每2周静脉注射240mg。本试验中的所有患者都曾接受过全身化疗,58%的患者接受过2种或以上的治疗,32%的患者曾接受过贝伐单抗治疗。入选患者时不考虑PD-L1表达。试验总体RR为26%(95% CI 9.1–52.2)。在这项试验中,38%的患者PD-L1阴性,84%的患者有两条或两条以上的治疗路线。平均PFS为5.1个月,OS为21.9个月。标志性的12个月生存率为78%,24个月时为50%。在PD-L1阳性和PD-L1阴性肿瘤中均有反应,提示该标记物可能不是宫颈癌PD-1检查点抑制所必需的。
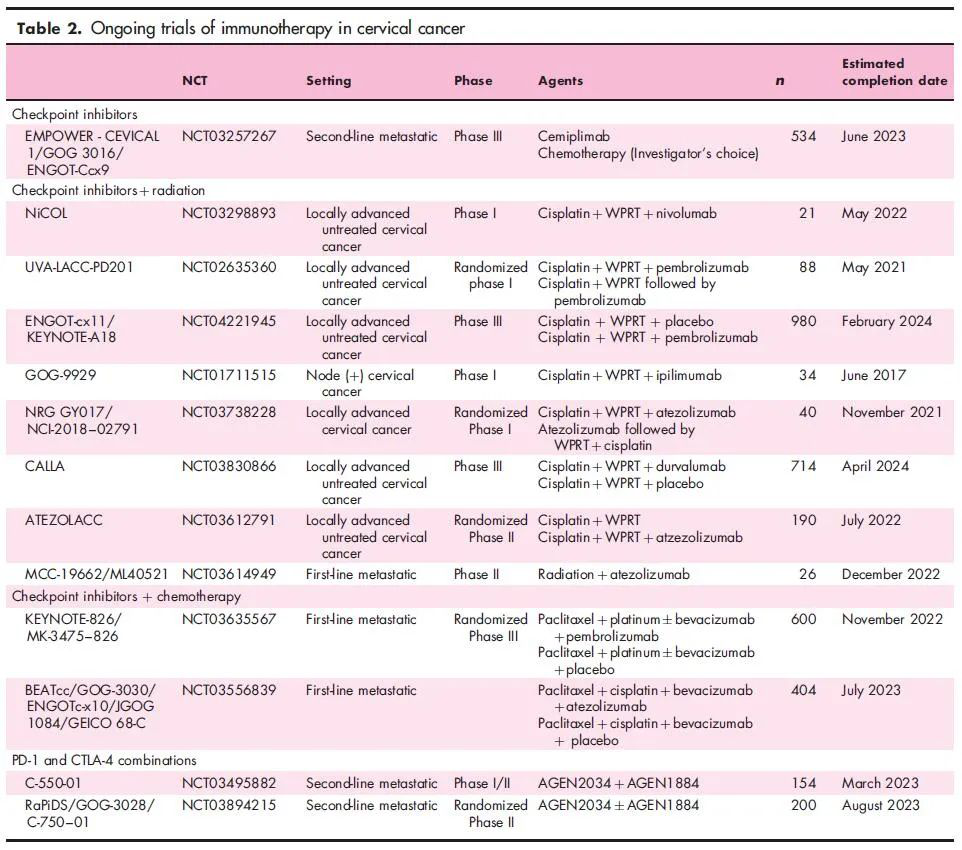
表2:来源参考文献1
参考文献:
1. Advances in immunotherapy for cervical cancer. Curr Opin Oncol. 2020 Sep;32(5):481-487.

