
北京时间2020年11月30日,欧康维视宣布其治疗慢性非感染性葡萄膜炎产品OT-401在海南博鳌启动真实世界研究,同时OT-401累及眼后段的慢性非感染葡萄膜炎受试者中评价氟轻松玻璃体(FAI)植入剂的安全性和有效性的Ⅲ期临床研究亦正在全国各临床中心进行中,真实世界研究数据将对III期临床数据产生良好的支持和补充。
“真实世界研究”这个词或许并不陌生,但很少有人能准确说出它的含义,更毋庸说了解它和传统临床试验研究的关系。真实世界研究(RWS)即在真实世界环境下收集与患者有关的数据,通过分析,获得医疗产品的使用价值及潜在获益或风险的临床证据。简单说就是,国外已经上市的药品或器械在国内试点地区进行销售,通过在实际诊疗中得到的患者数据帮助药品或器械在国内注册上市。
2019年10月17日,四家知名跨国药械医疗企作为第一批试点,在海南博鳌乐城开展真实世界数据研究,。包括艾尔建治疗青光眼的引流管,科利尔的NG声音处理器,强生用来治疗白内障的飞秒产品,以及美敦力治疗中、深度静脉曲张的封闭胶。2020年1月7日,国家药监局发布了《真实世界证据支持药物研发与审评的指导原则(试行)》(“《RWE指导原则》”),明确指出真实世界研究产生的真实世界证据可以用于支持药物研发和审评。其后,于3月26日,在首批真实世界研究试点名单出炉仅仅5个月后,国家药监局宣布美国艾尔建公司“青光眼引流管”注册申请成功通过审查,成为我国首个使用境内真实世界数据并成功获批上市的医疗器械产品,相较传统的医疗器械上市审批,“青光眼引流管”凭借真实世界数据结果从申报到获批上市的平均时间大大提前。可以看出药监局对于真实世界数据研究已经不仅仅停留在“纸上谈兵”了,相比于临床试验中苛刻的实验环境,真实病例诊疗中患者产生的有效性及安全性数据对于药品的注册审批亦极具指导意义。相信有了艾尔建获批珠玉在前,我们有理由期待欧康维视的OT-401(Yutiq)上市进程将会大幅提速,如果按照艾尔建青光眼引流管5个月的审批速度来推测,OT-401的上市时间有望较其招股书预测提前一年以上,远超出市场预期,饱受病痛反复折磨的葡萄膜炎患者黎明将至。
图片来源:欧康维视官网
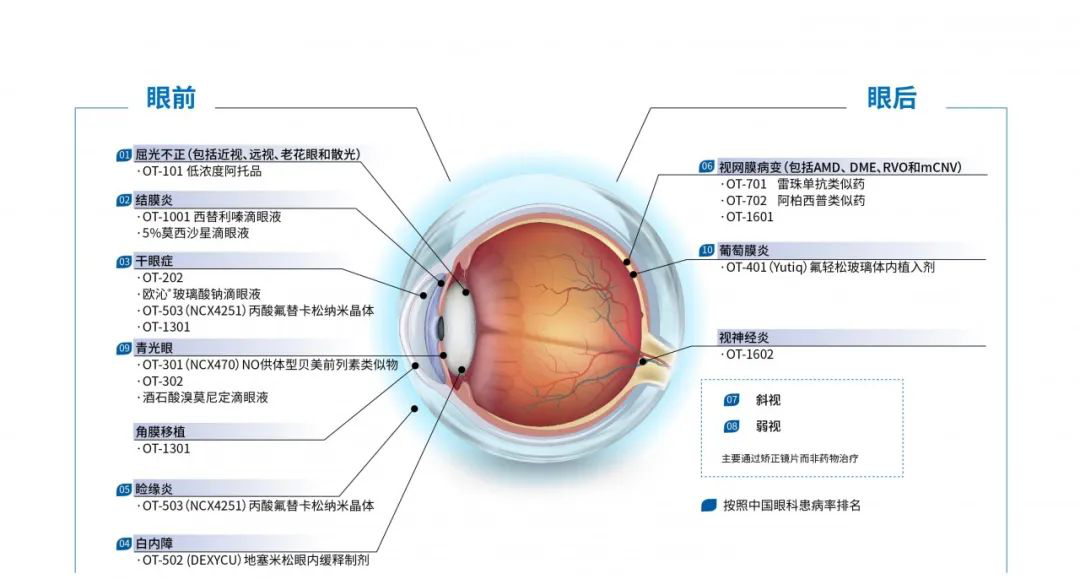
OT-401(氟轻松玻璃体内植入剂)作为目前治疗葡萄膜炎的first-in-class产品,OT-401具有低剂量眼底给药和长达36个月持续稳定释放药物的特点,大大改善了葡萄膜炎患者病情反复、传统治疗副作用大及用药依从性较差等问题,是首款且唯一经FDA 批准可释放氟轻松长达36个月的慢性非感染性葡萄膜炎疗法。葡萄膜炎患者最典型的特征是发病年龄早和容易复发,平均发病年龄约33岁,每一次炎症发作都会对眼内组织造成不可逆的损伤,46%患者最终发展为不可逆性的低视力或盲,是中国第二大致盲性眼病,而中国目前尚无慢性非感染性葡萄膜炎的标准治疗,OT-401的引进和开发将改善中国葡萄膜炎患者的治疗困境、延缓病情反复发作、避免全身诸多严重的并发症,并填补慢性非感染性葡萄膜炎治疗领域的空白。2018年10月12日美国FDA正式批准OT-401(Yutiq)上市,利用海南博鳌乐城“先行先试”等一系列特许医疗政策,欧康维视将这款创新产品以最快速度引入中国,开始进行商业化的早期探索,2019年8月29日在博鳌超级医院首位葡萄膜炎患者接受OT-401眼内注射,同时Ⅲ期临床试验也正紧锣密鼓地进行中。
上市以来,欧康临床进展斩获颇丰,OT-1001(Zerviate)及OT-301相继获批Ⅲ期临床,从绿叶制药引进抗VEGF药物OT-702(阿柏西普生物类似药),目前已有四款产品正在临床Ⅲ期,占中国眼科药物Ⅲ期临床数量的1/3。据了解,在博鳌超院已有超过30名患者接受了OT-401的注射,尽管价格不菲,但葡萄膜炎缺医少药的困境带来了巨大的需求缺口,也给欧康维视收集整理完备的真实世界研究数据提供了便利。欧康维视在临床试验、商业化与真实世界研究之间不断寻找动态平衡,努力摸索新兴政策带来的创新契机,敏锐的市场洞察力及极强的创新实力让欧康走在中国创新药企的前列。

