本周医药资讯一览:君实 PD-1/TGFβ 双抗临床申请获受理;恒瑞氟唑帕利胶囊获美国FDA国际多中心临床试验资格;人福琥珀酸美托洛尔缓释片获得美国FDA批准文号;NMPA附条件批准2款新冠疫苗;医保局:力争年底全国门诊费用跨省直接结算;FDA今日加速批准DMD疗法上市;康希诺业绩快报:2020年度净亏损4.07亿元……
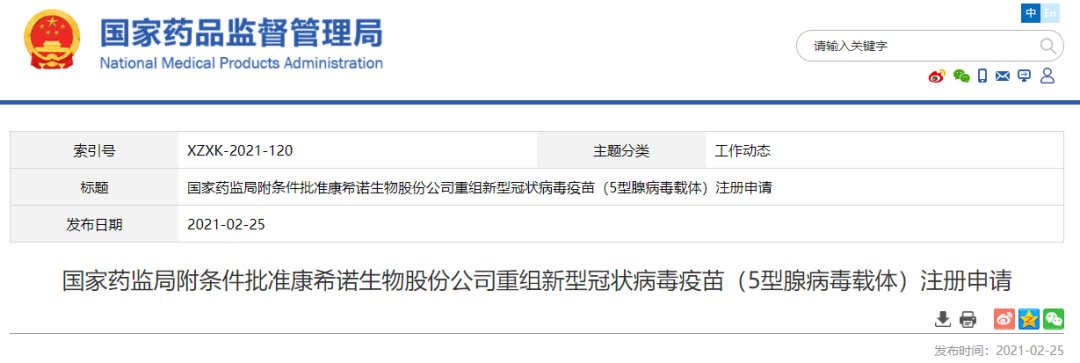
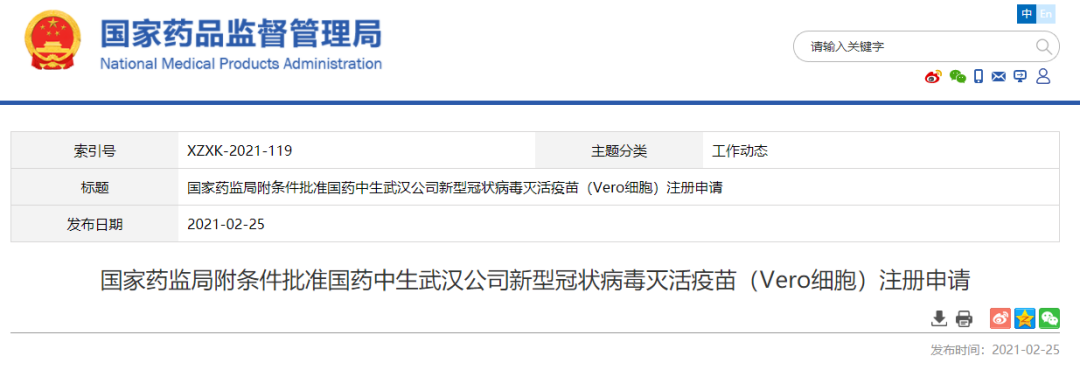
日前,国家医疗保障局回复全国人大代表杨绪松提交的议案时表示,力争 2021 年底在全国范围内基本实现门诊费用跨省直接结算。这意味着目前暂未开通跨省门诊费用直接结算的广东地区有望在年底实现异地就医时直接刷社保卡结算门诊费。(南方都市报)科技部:7款新冠疫苗进入Ⅲ期临床,4款获批附条件上市2月26日,科技部部长王志刚介绍,动员全国科技系统聚焦临床救治和药物、疫苗研发、检测设备和试剂等方向开展抗疫攻坚。一周内完成病毒基因测序、14天完成核酸检测试剂研发上市。疫苗研发5条技术路线并行推进,7款进入Ⅲ期临床,4款获批附条件上市。11种药物或治疗手段进入诊疗方案。参与世界卫生组织10个工作组,与美、欧、亚、非、拉美等国家开展科技抗疫交流合作,分享最新成果,提供中国方案。(财联社)2月22日,中国医药集团有限公司董事长、党委书记刘敬桢介绍说,今年国药中国生物新冠灭活疫苗产能在10亿剂次水平,可以充分供应市场。另外,适用于3-17岁人群的新冠疫苗不久也将投入使用。与此同时,刘敬桢透露,国药集团正在研发的新冠重组蛋白疫苗即将进入临床试验阶段。(财联社)NMPA附条件批准国药中生武汉所、康希诺新冠疫苗上市注册申请2月25日,国家药品监督管理局附条件批准康希诺生物股份公司重组新型冠状病毒疫苗(5型腺病毒载体)注册申请。该疫苗是首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。同时,附条件批准国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。该疫苗适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。(国家药监局)恒瑞医药:氟唑帕利胶囊获美国FDA国际多中心临床试验资格2月22日,恒瑞医药公告,公司已于美国时间2021年1月21日向美国食品药品监督管理局提交了氟唑帕利胶囊国际多中心临床试验申请并获受理。日前,公司已获得美国FDA国际多中心临床试验资格,并将于近期开展相关临床试验。除用于铂敏感的复发性卵巢癌、输卵管癌或原发性腹膜癌治疗外,氟唑帕利胶囊单药或联合甲磺酸阿帕替尼片的多个适应症开发已处在III期临床研究阶段,另有多种联合治疗方案,包括与阿比特龙联合、与抗PD-L1抗体SHR-1316联合、以及与替莫唑胺联合治疗多种实体肿瘤已处于临床开发阶段。(恒瑞医药公告)人福医药:琥珀酸美托洛尔缓释片获得美国FDA批准文号2月22日,人福医药公告,控股子公司宜昌人福收到FDA关于琥珀酸美托洛尔缓释片的批准文号。琥珀酸美托洛尔缓释片用于治疗高血压、心绞痛以及伴有左心室收缩功能异常的症状稳定的慢性心力衰竭。(人福医药公告)2月21日晚间,百奥泰发布公告称,于近日收到国家药监局核准签发的关于阿达木单抗注射液的《药品补充申请批准通知书》,该药品获批新增适应症:儿童斑块状银屑病。(百奥泰公告)NMPA药品审评中心最新公示,阿斯利康1类新药AZD9833获得三项临床试验默示许可,拟开发治疗乳腺癌。公开资料显示,AZD9833是一款在研口服雌激素受体降解剂,在中国境外已进入3期临床开发阶段。(医药观澜)2月24日,CDE官网显示,君实生物JS201注射液临床申请获受理。JS201是一款PD-1/TGFβ双特异性抗体,目前,国内未有其他企业开发PD-1/TGFβ双抗。根据君实官方披露的信息,JS201的PD-1抗体部分基于特瑞普利单抗,临床前研究显示,同时抑制PD-1和TGFβ通路较之单药疗法可增强T细胞激活,疗效更佳且安全性可控。(Insight数据库)2月22日,海王生物发布公告称,控股子公司深圳海王医药的枸橼酸西地那非片(50mg、100mg)获批上市。枸橼酸西地那非片用于治疗性功能勃起障碍,是辉瑞开发的一种5型磷酸二酯酶选择性抑制剂。(米内网)2月26日, Sarepta Therapeutics公司宣布,美国FDA已经批准该公司开发的反义寡核苷酸疗法Amondys 45上市,用于治疗特定类型的杜氏肌营养不良症患者。这也是近3年以来,FDA加速批准的第三款基于外显子跳跃的DMD反义寡核苷酸疗法。(药明康德)2月25日,奥赛康发布公告称,子公司于近日收到NMPA下发的塞瑞替尼胶囊新药上市申请《受理通知书》。本品适用于间变性淋巴瘤激酶阳性的局部晚期或转移性非小细胞肺癌患者的治疗。奥赛康是首家完成生物等效性试验提交生产注册申请的企业。(奥赛康公告)2月25日,Kura Oncology宣布,其在研疗法tipifarnib获得了美国FDA授予的突破性疗法认定,用于治疗携带HRAS基因突变的头颈部鳞状细胞癌患者。Tipifarnib是一种强效的选择性口服法尼基转移酶抑制剂,可以间接抑制HRAS蛋白活性。(药明康德)2月25日,艾伯维/Allergan宣布已向美国FDA提交AGN-190584(1.25%毛果芸香碱滴眼液)的新药上市申请,用于治疗老花眼。FDA预计将在2021年底做出审批决定。(医药魔方)2月25日,康希诺发布业绩快报,2020年全年净亏损4.07亿元,上年同期亏损1.57亿元。报告期内营业总收入同比增长990.06%,主要系公司本年实现疫苗产品收入所致;亏损持续增加,相关各项利润指标变动幅度较大,主要原因为公司加大研发投入。(科创板日报)2月25日,据彭博社消息,数字健康独角兽“微医”计划最快下月申请香港IPO,估值接近70亿美元。对此,微医对蓝鲸财经记者表示,关于IPO的情况不予评论。自2020年6月,微医上市消息一直为业内热议。有知情人士称,微医正将业务一分为二,计划将其医疗咨询和医药电子商务业务上市。当时,微医方面对蓝鲸财经记者称暂不回应。(蓝鲸财经)2月25日,默沙东宣布和Pandion Therapeutics达成最终协议,以每股60美元的价格收购Pandion的所有流通股,折合后股权对价合计18.5亿美元。Pandion致力于开发解决自身免疫性疾病患者未满足需求的创新疗法,包括IL-2融合蛋白PT101以及PD-1激动剂,默沙东通过此次收购补强了自身的免疫疾病产品管线。(医药魔方)动脉网获悉,近日,好医生云医疗宣布完成超亿元人民币(等值美元)A轮融资,领投方为奥博资本OrbiMed。本轮融资后,好医生云医疗将加速在基层互联网医疗市场的推进与升级,推动营销及服务体系的创新、提升和完善,持续拓展及整合业务结构,夯实核心竞争力。(动脉网)