导读:近期,美国FDA批准了QED Therapeutics, Inc.公司的一类新药infigratinib用于治疗符合特定标准的成年胆管癌患者。此前,该药品获得FDA优先审批和孤儿药资格!
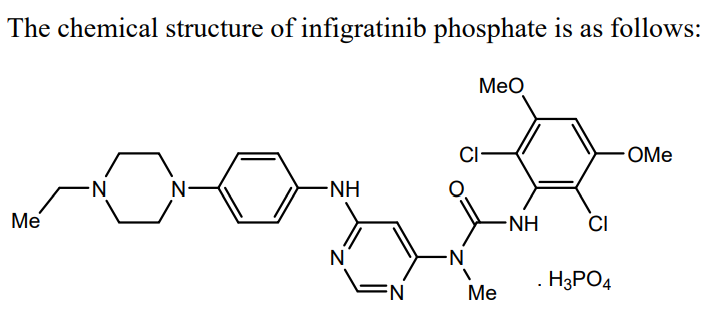

infigratinib是一种激酶抑制剂,适用于治疗既往接受过治疗的、不可切除的局部晚期或转移性成人胆管癌患者,其伴有成纤维细胞生长因子受体 2 (FGFR2) 融合或经 FDA 批准检测方法检测到的其他易位。
作为 FGFR 的小分子激酶抑制剂,对FGFR1、FGFR2、FGFR3和FGFR4的 IC50值(半抑制浓度,half maximal inhibitory concentration)分别为1.1、1、2和61nM。与 infigratinib 相比,infigratinib的主要人体代谢物BHS697和CQM157,对FGFR1、FGFR2和FGFR3具有相似的体外结合亲和力。Infigratinib通过激活FGFR扩增、突变或融合,来抑制 FGFR 信号传导,并降低癌细胞系中的细胞增殖。本构FGFR信号可以支持恶性细胞的增殖和存活。
Infigratinib 在具有激活 FGFR2 或 FGFR3 改变的人类肿瘤的小鼠和大鼠异种移植模型中具有抗肿瘤活性,包括表达 FGFR2-TTC28 或 FGFR2-TRA2B 融合的两种源自患者的胆管癌异种移植模型。Infigratinib在大鼠中单次口服给药后显示脑部与血浆浓度比(基于 AUC0-inf)为 0.682。
此前:
2020年4月17日,美国FDA批准了胆管癌靶向药物Pemazyre (pemigatinib)。
参考资料

