PART
为何License-in模式有争议?
所谓的License-in就是许可引进,作为“引进方”向“授权方”支付一定的首付款,并且约定一定金额的里程碑费用,从而获得产品在某些国家(地区)的研发、生产和销售的商业化利润。
大家都知道研发新药不容易,周期长,风险高,竹篮打水一场空是常有的事情,同时也需要大量的资金投入,好不容易有点理想和情怀,也禁不住现实的屡次捶打。在创新这个高风险高回报的道路上,License-in模式毫无疑问具有优越性。一方面它可以跳出自身研发能力的局限性,尽可能丰富管线和研发方向,与现有的产品形成互补,满足市场的需求,另外一个方面,它可以促进国外先进技术在我国的快速落地,提高自身的二次研发的能力,保持和国外产品几乎相同的产品周期,节省获批时间。
同样因为这些便利性,License-in模式也创造了一个“赚快钱”的捷径,原本是助力创新的拐杖,现在却被当成行走的双脚,好不好走不要管,自己原本的脚能不能走不要理,反正走到了证券化这一步,也就离变现目标所差不远了。
原来只有大佬才能打的桌牌,现在多少都可借几个牌上桌凑个热闹。一个具有研发能力的团队,加一笔投资,再加一个授权引进,License-in模式可以快速拼凑出一个创新药企的形象。
在License-in包装下的创新药企到底含金量有几分还是需要大家估量一下的,有浑水摸鱼的,也有老实研发的,其根本评判标准还是在License-in过程中,自己到底投入了多少的科研力量,对于外部的技术依赖有多少,原创占比究竟几何。
有争议的不是License-in模式,而是借助License-in开展的资本圈钱游戏。
海和药物出了什么问题?
最近被各大医药财经报道的海和药物的科创板上市失败之热闹,其原因是海和是自科创板成立以来,首家在第一次暂缓上市后第二次被否的医药企业。
海和药物成立于2011年,由中国科学院上海药物研究所和上海张江科技投资有限公司联合创立,专注于抗肿瘤创新药物发现、开发、生产以及商业化的自主创新生物技术。
根据海和药物的招股书,当前在研主要有九种化合物,涉及多种靶点,进展最快的是RMX3001和ON101,已到达临床Ⅲ期,德立替尼、谷美替尼处于关键性 II 期注册临床试验阶段,其余大部分均处于临床Ⅰ期或者更早阶段。也就是说目前主营管线并无一个实现商业化,上市后实际的营收情况尚待不明。
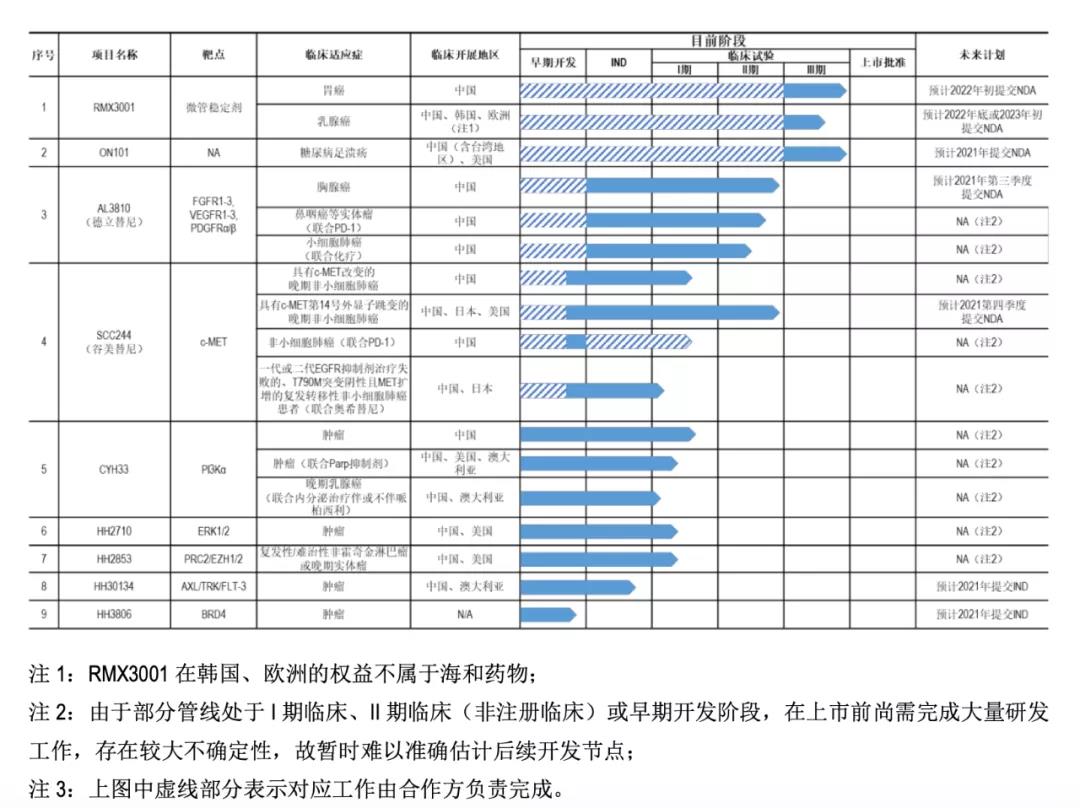
RMX300是海和药物2017年9月从韩国大化引进的产品,适应症为晚期和转移性或局部复发性胃癌,是全球第一个开发成功并获批上市的口服紫杉醇产品。海和药物拥有其在中国大陆、中国台湾、中国香港及泰国的独占权益,在整个管线研发中,参与 III 期临床试验。
ON101是海和药物与台湾合一生技集团合作研发的天然药物复方制剂,其在糖尿病足部溃疡的伤口愈合效果方面表现优良。同样,海和并未参与ON10相关专利的发明工作,只涉及到 III 期临床实验。海和药物共享未来 ON101 在中国大陆的销售提成。
德立替尼是由海和药物通过授权许可引进的以 VEGFR1-3、 FGFR1-3、PDGFRα /β为靶点的小分子选择性酪氨酸激酶受体抑制剂,海和药物拥有其在中国境内的独占权益。
谷美替尼(国内代号 SCC244)为海和药物与上海药物所合作研发的口服强效高、选择性 c-MET抑制剂,海和药物拥有谷美替尼的全球开发权益。除此之外,海和药物和药物所还合作了CYH33、HH2710、HH2853、HH30134等项目。
上述是海和药物的四个最接近临床上市的四个项目概况,综合整个管线情况,不难发现,除了正处于临床前阶段的HH3806项目以外,海和药物的其他管线皆为授权引进和合作研发项目。
针对以上情况,问询三问,其一海和药物与韩国大化、药物所等主要合作方在核心产品研发过程中的分工情况,其二,海和药物在与药物所合作中,均委托药物所进行项目授权引进及基础研究,海和药物是否对药物所持续构成技术依赖,其三,海和药物是否独立自主对引进或合作开发的核心产品进行过实质性改进且未对合作方构成持续技术依赖。
海和药物依靠“自主研发+合作研发+授权引进”这样一个药物研发体系,丰富多管线的产品,但是在这样一个创新药企的形象背后,其核心研发实力却屡次被质疑,屡屡被诟病是“拿来主义”。
同时除了无核心自主研发产品以外,海和药物的亏损也令人瞩目,从招股书上看出,除了2018年和2019年营业收入各逾1500万以外,2017年和2020年的前三个季度营业收入均为0,连续四年亏损,共计13.49亿元,甚至2019年其负债率一度高达211%。连年的亏损对其研发投入、业务拓展、人才稳定等各个方面都造成了相当的压力,并且目前公司的资金来源主要依赖于外部融资,如果公司在未来的一段时间内盈利,再加此次上市失败,对于未来产品的商业化更会增添多重压力。
License-in模式未来该怎么走?
毫无疑问,License-in只是一个补充,是短期的发展,自己的“硬实力”才是长期发展的根源力量,也是市场的托盘。从这一方面我们不妨看看国内License-in模式践行者再鼎医药的变化。
关于再鼎模式,可以阅读此篇文章(豪掷3.38亿美元license in,一文看懂“再鼎模式”)
一方面License-in的引进成本越来越高,好产品价格水涨船高,且随着降价集采、医保谈判等问题的浮现,竞争压力与日俱增;另外一方面,监管层对于企业自身的“科创实力”的看重以及CDE的以患者需求为核心的指导意见,都迫使过往的License-in模式发生转变。
在再鼎公布的半年财报中,披露了其三个自研产品的研发进展,分别为IL-17新型人源纳米抗体,靶向CD47的经改良以降低效应物功能的人源化IgG4单克隆抗体ZL-1201,以及首次披露的靶向CDC7的ZL-2309。但该三者都还处于早期发展阶段,未来还有待观望。
再鼎医药积极推进与多个技术平台公司合作,2021年8月4日与 Schrödinger公司达成基于其物理计算药物发现平台的合作,以期提高了候选药物进入临床开发的效率及可能性。除此之外,还与MacroGenics平台进行技术开发的合作,获得使用MacroGenics多特异性平台 DART® 和 TRIDENT®以及一个针对实体瘤的主要研究项目的权利。
License-in可以不光是药品,还可以是技术,相比于产品,技术所带给一个企业的创新更具有长久性和发展性,同一个技术,大家可以开拓不同的靶点,竞争差异化。
授人以鱼不如授人以渔,License-in模式也不光是单纯的“买买买”,核心还是要加强自我的研发实力。对于海和药物的否定表现出了监管层对于企业创新和研发能力的重视和审视。仅仅依靠License-in和合作研发,自身实力不强,科创属性较弱的企业折戟也必然是一个常态化事情。
参考资料:
1.http://kcb.zqrb.cn/html/20210917/news-334-495932.html
2.海和药物招股书
3.再鼎医药官网

