中国国家药监局药品审评中心(CDE)网站公示显示,辉瑞(Pfizer)申报的elranatamab获得一项临床试验默示许可,拟用于以下适应症:单药或联合达雷妥尤单抗,用于既往接受过至少1线抗多发性骨髓瘤治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤患者。公开资料显示,elranatamab是一款靶向BCMA和CD3的双特异性抗体药物,在全球已进入3期临床研究阶段。

B细胞成熟抗原(BCMA)是TNF受体超家族中的一员,主要表达在多发性骨髓瘤细胞系及多发性骨髓瘤患者的细胞中,且表达呈现出随着疾病的进展而增加的特点,因此成为了治疗多发性骨髓瘤的理想靶点。根据辉瑞公司此前公开资料介绍,elranatamab(PF-06863135)是一款皮下注射、靶向BCMA和CD3的双特异性抗体,它的一端与BCMA相结合,另一端与T细胞表面的CD3受体结合,从而可以激活T细胞杀伤表达BCMA的癌细胞。此前,elranatamab已经在一项治疗复发/难治性多发性骨髓瘤患者的1期临床试验中证明了其安全性和对多发性骨髓瘤的高缓解率,接受剂量为每周1000 μg/kg治疗的患者中83%获得应答。此外该药所有皮下注射的剂量水平的安全性均可控,未观察到剂量限制性毒性。2021年1月,elranatamab获得美国FDA授予的快速通道资格,用于治疗复发/难治性多发性骨髓瘤。
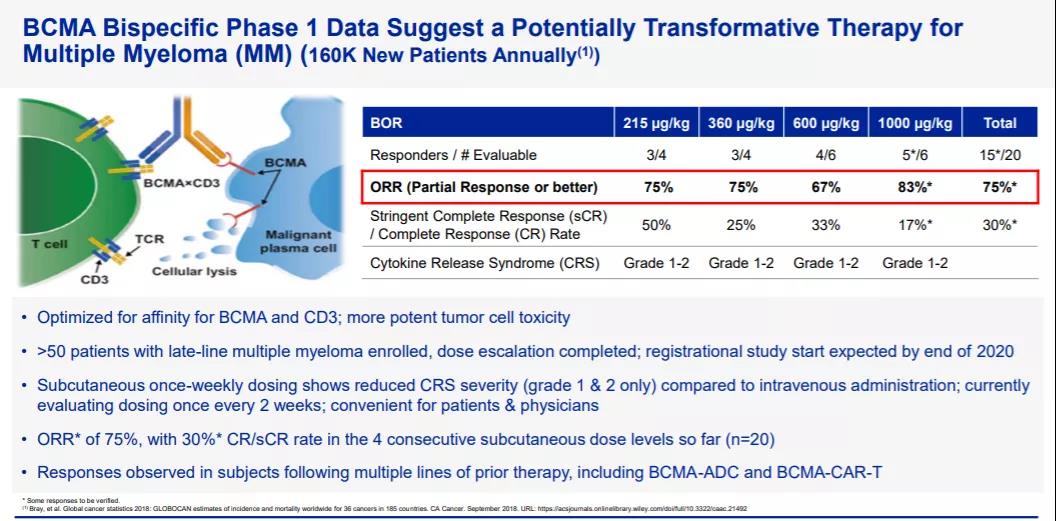
▲elranatamab简介(图片来源:辉瑞公司官网)
ClinicalTrials官网显示,目前elranatamab正在针对多发性骨髓瘤患者开展多项2期或3期临床研究。其中,一项名为MagnetisMM-5的3期临床研究已经于2021年8月开始进行,该研究将评估elranatamab单药或联合达雷妥尤单抗注射液,对既往接受过至少1线抗多发性骨髓瘤治疗(包括来那度胺和蛋白酶体抑制剂)的复发/难治性多发性骨髓瘤患者的疗效和安全性。在中国,elranatamab此前已获得一项临床试验默示许可。目前,该产品正在三重难治性多发性骨髓瘤患者中进行一项评估安全性、药代动力学、药效学和疗效的1b/2期开放性研究。希望辉瑞公司elranatamab在临床开发中进展顺利,早日为更多多发性骨髓瘤患者带来新的治疗选择。
参考资料:
[1]中国国家药监局药品审评中心官网-临床试验默示许可.Retrieved Jan 19,2022,from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2] Oncology. Retrieved February 2, 2021, from https://s21.q4cdn.com/317678438/files/doc_presentations/2020/09/Oncology_FINAL.pdf
[3] Pfizer Initiates Pivotal Phase 2 MagnetisMM-3 Trial of BCMA-CD3 Bispecific Antibody Elranatamab (PF-06863135) in Multiple Myeloma. Retrieved Feb 17,2021,from https://www.pfizer.com/news/press-release/press-release-detail/pfizer-initiates-pivotal-phase-2-magnetismm-3-trial-bcma
文章来源:医药观澜



