自辉瑞新冠口服特效药Paxlovid被批准在国内进口注册以来,部分社交媒体“辉瑞来中国高价卖药割韭菜”、“辉瑞将在新冠特效药上卡脖子中国”的言论甚嚣尘上。
由此,胡锡进还特别写了一篇《中国进口部分辉瑞生产的新冠口服药,这应该争议吗?》来纠偏,文章中提到一些市场争议的观点:“美国对中国充满敌意,怎么可能把真正的好东西给中国?他们卡中国芯片的脖子,为什么要把新冠特效药给我们?甚至有人怀疑,辉瑞卖中国Paxlovid,就是要害我们。”
这些观点的原罪,更多的是将地缘政治矛盾所产生的质疑移驾到Paxlovid身上,有人可能会联想到FDA拒绝信达、迟迟未批复国内某些创新药企的EUA申请,从而诞生出非常多阴谋论的观点。
我认为,与其做这些无用的质疑,不如将力气与思考聚焦在“我们自己怎么样”。
想必质疑的这些人,忙于站队,并没有反思过国内生物医药产业的现状。
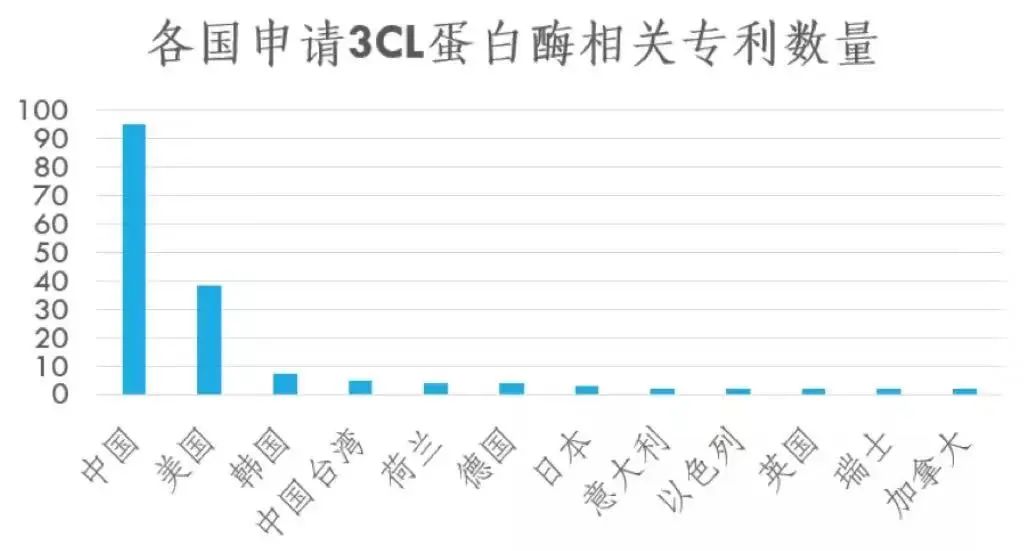
1、以辉瑞Paxlovid对应的3CL靶点为例,中美是专利积累是最多的两个国家,但是却被辉瑞最先做出来,不应该反思?辉瑞Paxlovid所对应的3CL蛋白靶点被发现于19年前,早在SARS疫情期间就已经有相关研究。中国3CL蛋白酶方面积累深厚,中国申请3CL蛋白酶相关专利已公开数量为95个,位居全球第一,而美国相关专利数量虽然位列第二,却不及中国一半。
辉瑞最早开始进行Paxlovid的研发于2020年3月,用了将近1年的时间将其推进至临床阶段,随后快速推进临床,最终于2021年底获得FDA的紧急使用批准。
反观国内,大部分3CL蛋白的专利都在国内高校和研究所手里,国内第一个药企和3CL靶点口服药物的合作,是先声药业的SSD8432,该管线于3月30日进入临床,比辉瑞慢了整整一年,这里无疑暴露了国内前沿医学转化的问题。
在新冠药物开发层面,过去国内药企引以为傲的Fast follow策略俨然成了Slow follow。
而国内药物创新,病根恰恰在于过去以Fast-follow为主导的研发策略身上。业内有一个著名双十定律,一个创新药从研发到最后上市需要“10年、10亿美金”,而德勤的数据显示,2018年一款新药研发费用已攀升至21.68亿美元,相当于2010年11.88亿美元的2倍。
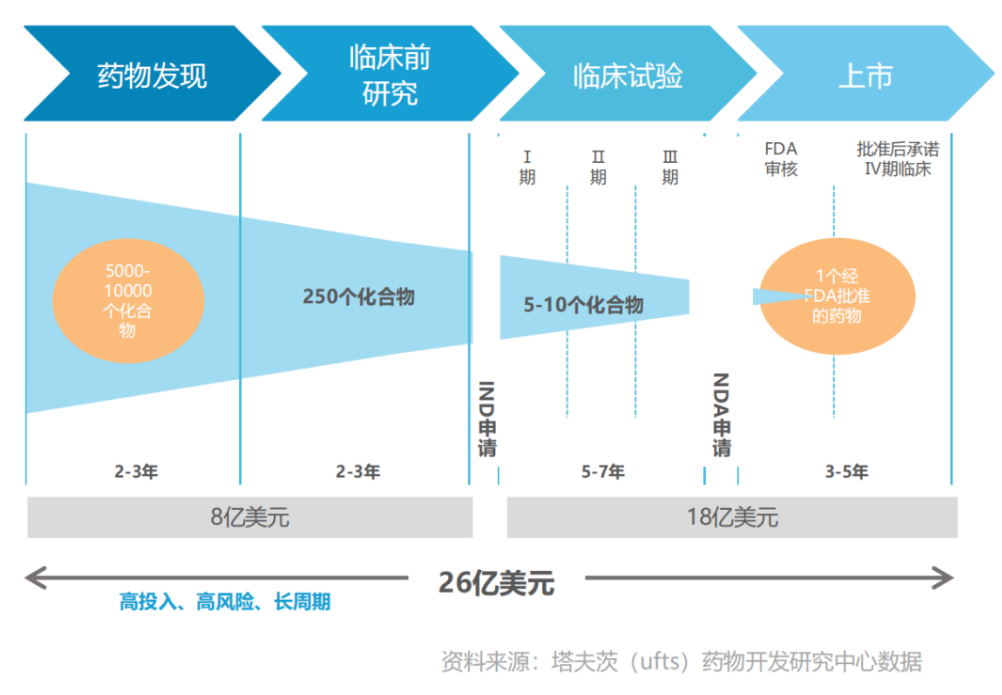
反观国内创新药药企,过去几年研发成功率远高于全球药企,并且成本较低,这显然是跟进式创新带来的好处。比如恒瑞的PD-1卡瑞利珠单抗从自主研发到获得注册批件,其间累计投入的研发费用仅为5.04亿元,该成本费用要远低于MNC收购一个PD-1的代价,但同时也加速了内卷的发生。国内创新药研发从Fast-follow转变至Smart follow/First in class其实需要时间,但实际上造成问题不仅仅在于药企,还在于资金。我想国内许多创始人在介绍自己First in class靶点管线时,都会遇到一个共同的拷问:海外有对标的管线吗?/这个靶点(机制)被验证过吗?
本质上,过分逐利和追求确定性的资金,不仅带偏了部分国内Biotech的研发导向,同时也是一种极度不自信和过于浮躁的表现。出海(去美国割韭菜),一直是国内创新药企的终极荣耀。信达PD-1的折戟,并不可以成为FDA“卡”的明确支撑论据,因为实在有太多的毛病可以被挑出来。
美国FDA作为全球最严苛、标准最高的药械监管审批机构,被无数双眼睛注视着,稍有不客观、不公正,便会迎来巨大的舆论压力。(换言之,假设主观态度是倾向卡的,多少也要注意影响。)而且,被FDA拒绝的不仅仅只有信达。据人民日报数据统计,近一年来有17款产品被FDA拒绝,其中不乏默沙东、礼来等MNC的身影,总结下来有四大原因:安全性数据存疑、患者临床数据单一、临床获益不够明显、生产设施存在缺陷。所以前文提到,尽管不排除FDA有偏好,但最终还是要回归产品管线本身。传奇生物BCMA CAR-T就给国内药企证明了:申报的产品足够好(全球第二款),对患者益处足够多(有效性&安全性优于Bluebird),就不怕别人挑毛病(遵循FDA监管要求、多中心临床)。这也通透了一个道理:中国创新药企可以来美国分享市场,前提是你要真的有实力,Me-too是不行的,First in class、Best in class没问题。
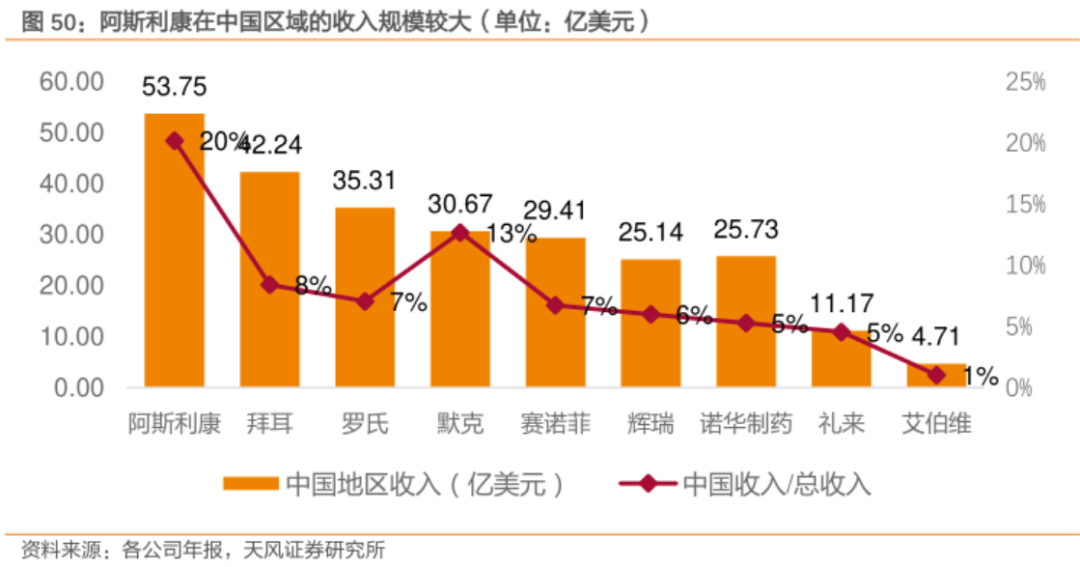
2021年,全球MNCs在中国的收入均实现了强劲的增长,如罗氏、阿斯利康中国地区营收已超过60亿美元,即便是体量较小的礼来也实现了接近20亿美元的营收,这足以证明中国拥有足够的医药市场空间。
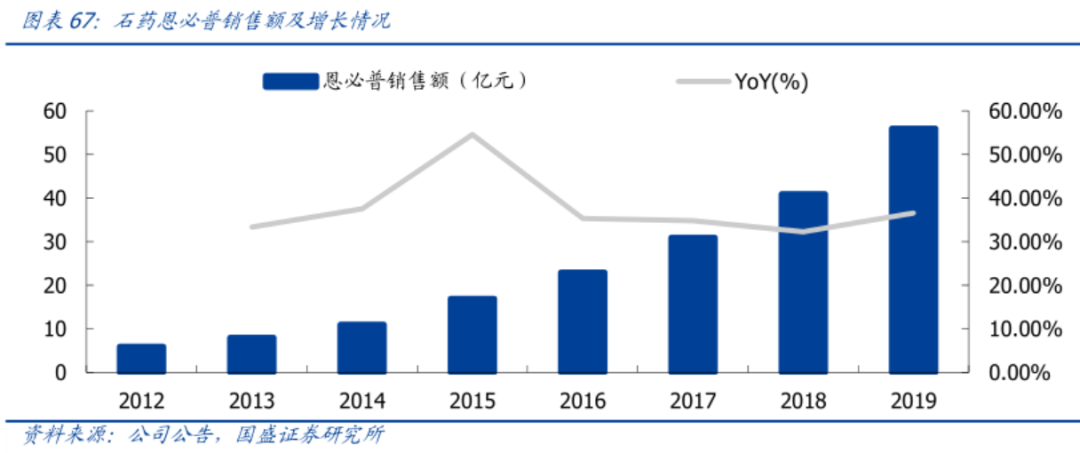
“在国内内卷没有前途”,这句话虽然观点很正,但仅局限于内卷,差异化创新在国内绝对是有前途的。石药的当家产品“恩必普”、先声药业的“先必新”或许是最好的明证。过去市场被统筹性的观点所误导,普遍认为国内药物市场没有超额利润,但其实需要客观看待。从2018年12月到2022年4月,4年不到的时间里国内就上市了7个PD-1,年治疗费用从10多万降至2-3万。在同类竞品普遍存在的情况下,企业很难有超额的利润和溢价,最终参与医保谈判降价是唯一坦途。反观部分进口新药,以罗氏的曲妥珠单抗(国内2002年获批)为例,2017年进入医保前一直保持2.45+万/瓶的价格,很重要的原因在于国产缺乏竞品(2021年专利才到期、国产Follow近两年上市)。同样产品价格坚挺的情况,也反馈在国产高值耗材上(如强生手术可吸收缝线)。
产品足够创新令患者受益,没有同类竞品可替代,凭什么大幅降价?怎么可能不存在超额利润?
药企没有利润,别怪政策,首先自己要反思的是研发策略。继去年的CDE临床指导意见发布后,4月11日,CDE发布公开征求《双抗类抗肿瘤药物临床研发技术指导原则》意见的通知,意见稿明确指出:原则上双抗的关键性研究试验应与当前最优标准疗法(SOC)设计对照。且如果拟定立题对应适应症的SOC已包含双抗中任一靶点的单抗品种或其联用,则试验设计应与含有该单抗或其联用的治疗方案进行头对头对照。政策的重重加码,意味着国内的CDE监管水平和认知正在进化,向欧美监管机构看齐。
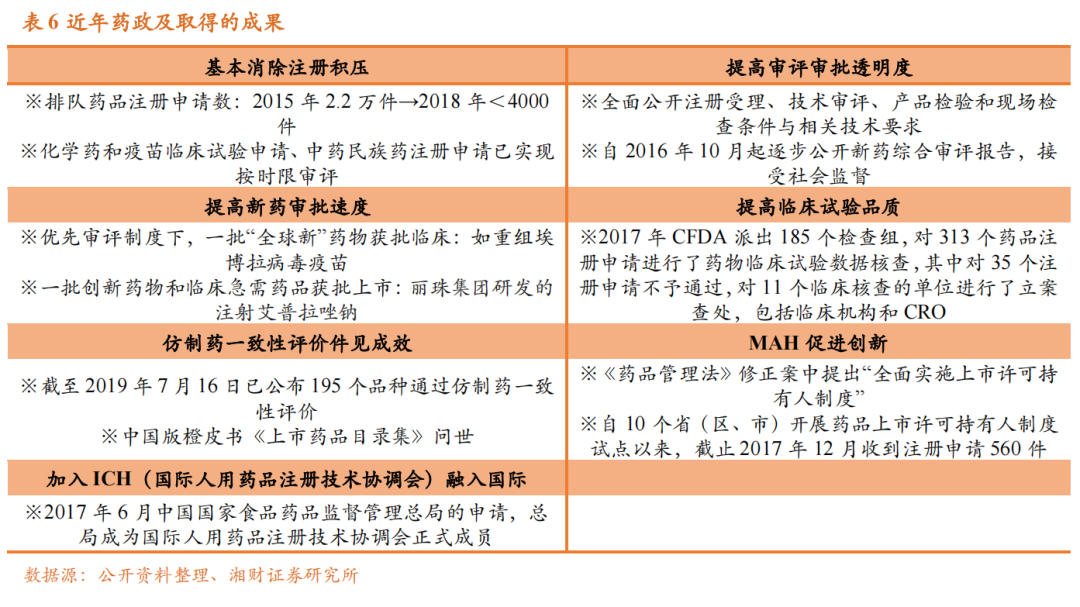
不难理解曾有大量的声音在质疑临床试验生意的“干净度”,核心的质疑点在于:过去有大量的临床为了体现好的数据对比结果,对照组是采用非最优的标准疗法(或安慰剂)治疗患者,这本身就是对入组患者生命安全的漠视,并且大量低质量同质化的临床充斥,同样也将带来极大的不安定因素和资源浪费。换一个角度看,生物科技估值泡沫的破裂未尝是一件好事情,监管层利用政策疏导和市场先生自有的调节,将大量不具备研发竞争力的企业做一次供给侧改革,这将使得大量的Pd1、CD19 Car-t同质化管线淘汰,进而让更多有能力的Biotech享用优质的临床资源。结语:太阳底下没有新鲜事,或许这一次的医药熊市只是国内生物医药产业长期繁荣的一朵小浪花。中国作为“开放”的受益者,我们更应该汲取全球的优秀技术和经验,将其转化为自身内核,奋力前进,而不是自乱阵脚。
文章来源:瞪羚社