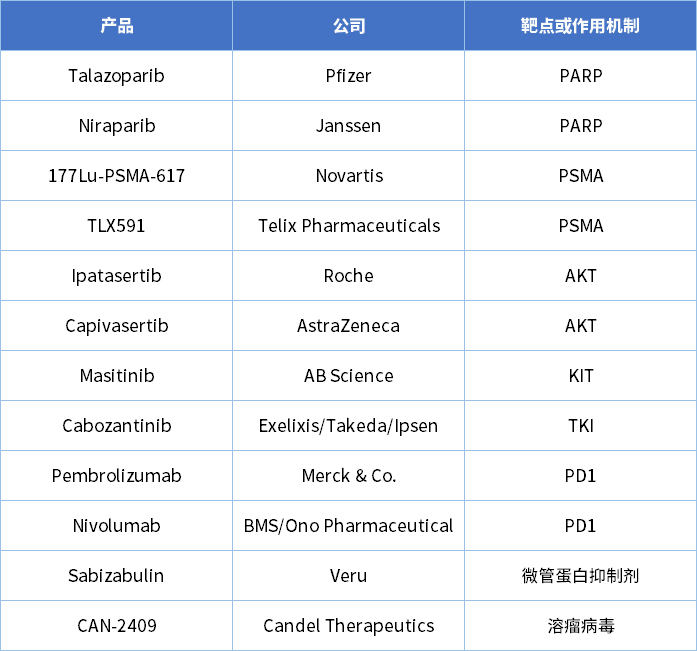
以下文章来源于:药智网,作者费翔
近日,美国临床肿瘤学会-泌尿系肿瘤研讨会(ASCO-GU 2023)于旧金山开幕。会议官网报道了辉瑞的PARP抑制剂Talzenna在治疗转移性去势抵抗性前列腺癌(mCRPC)2期和3期临床试验中的优异表现。
随着以辉瑞Talzenna为代表的全球PARP抑制剂研发推进,终极对决一触即发,这轮battle究竟谁赢?
PARP抑制剂作用机制
PARP全称为Poly ADP-ribose Polymerase,其作用机制是通过抑制PARP1或PARP2的活性,阻止PARP蛋白从DNA损伤位点上脱落并束缚在DNA上,从而干扰细胞对DNA损伤的修复过程。这会导致细胞无法进行顺利的DNA复制,并且在复制过程中引发同源重复修复(HRR)等DNA修复方法。但是,当HRR失去正常功能时,细胞通常会引入大规模的基因组重组,最终导致细胞死亡。
这种治疗策略,主要针对BRCA1/2突变携带者的肿瘤患者,因为这些患者的DNA修复机制受到了影响,更容易受到PARP抑制剂的影响。
目前,PARP抑制剂已经被证明可以有效治疗BRCA1/2相关乳腺癌和卵巢癌等一些固体肿瘤。此外,PARP抑制剂还被研究用于治疗其他类型的癌症,如前列腺癌、胰腺癌、肺癌等。
它是第一种成功利用合成致死(Synthetic Lethality)概念获得批准在临床使用的抗癌药物。
2020年初,FDA批准了两种用于治疗前列腺癌的PARPi——rucaparib(Rubraca®)和olaparib(Lynparza®)——这两种药物都被证明可以延缓转移性去势抵抗性前列腺癌(mCRPC)男性的癌症进展。
获得加速批准的Rucaparib是批准的两个PARPi中的第一个,适用于治疗具有有害BRCA突变(种系和/或体细胞)并且之前接受过雄激素受体导向治疗和以紫杉烷为基础的化疗。rucaparib的批准得到了一项名为“TRITON2”的多中心单臂试验的支持,该试验招募了患有mCRPC和有害BRCA突变的患者。该研究报告了44%的总体反应率(这与具有生殖系或体细胞BRCA突变的患者相似),以及55%的前列腺特异性抗原(PSA)反应率,在BRCA2改变的患者中更高。
在rucapaib获得批准后不久,FDA宣布根据PROfound临床试验的数据批准奥拉帕尼,该试验评估了奥拉帕尼与Xtandi(恩杂鲁胺)或Zytiga(阿比特龙)在先前治疗取得进展并具有合格基因突变的mCRPC男性中的疗效在参与同源重组DNA修复途径的15个预先指定的基因中至少有一个(例如BRCA1/2、ATM和CDK12)。该研究表明,与BRCA1/2或ATM基因突变患者的对照疗法相比,奥拉帕尼可延缓癌症进展。
2022年10月,辉瑞(Pfizer)对Talzenna-2进行了toplined,这是一项比较Talzenna加Xtandi与Xtandi的一线研究,并表示已向FDA提交了数据。预计将由FDA决定Talzenna应获得多广的应用范围,答案今年就会揭晓。
与利普卓的竞争才刚开始
Lynparza(利普卓)是中国批准治疗晚期前列腺癌的第一个PARP抑制剂,也是唯一一个与新型激素疗法(NHT)相比能显著改善BRCA突变mCRPC患者总生存期(OS)的PARP抑制剂。
2021年6月24日,阿斯利康和默沙东共同宣布,其共同开发和商业化推广的PARP抑制剂奥拉帕利片(商品名:利普卓®)已获得中国国家药品监督管理局(NMPA)附条件批准,单独用药治疗携带BRCA突变且既往治疗失败的mCRPC前列腺癌成人患者。
基于PROpel临床研究,欧洲监管机构于12月批准Lynparza与Zytiga一起用于不打算接受化疗的mCRPC患者。但FDA最近将其对该申请的决定日期推迟了三个月,以进行全面审查。
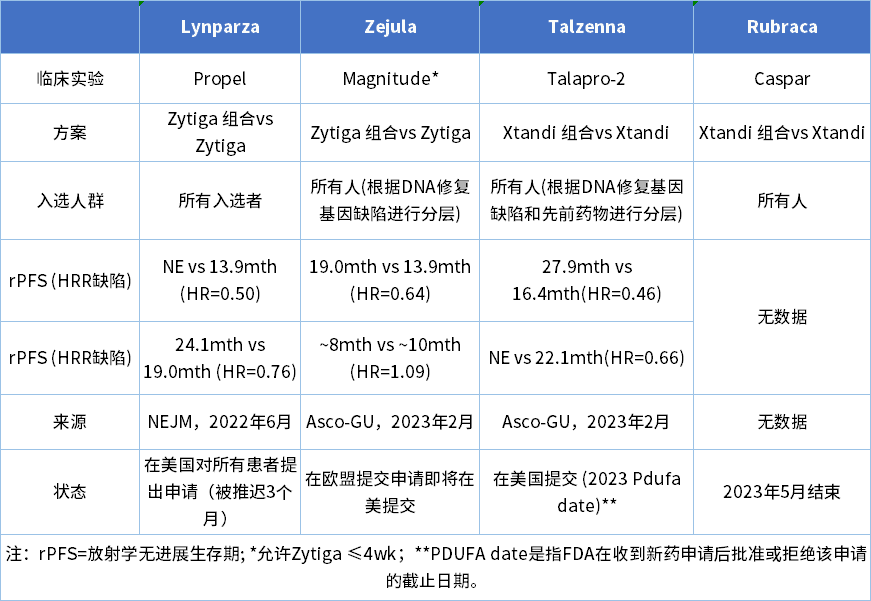
表1 治疗前列腺癌的一线PARPi药物比较