
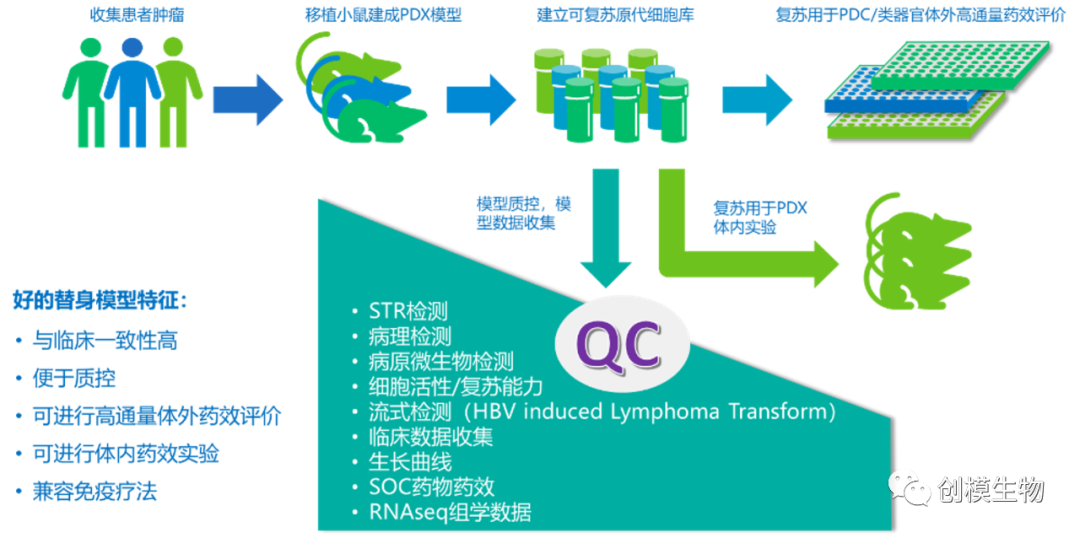
以PDX模型为代表的替身模型自从投入使用以来,已经证明了在新药研发中,可以有效加速研发进程,提高研发成功率,节省综合研发支出。但是单一的PDX体内模型仍然无法完全满足新药研发早期阶段,对于药物通量和模型通量的共同需求,因此建立以多种体外体内替身模型为基础,在药物研发的早期阶段使用类器官/PDC等体外平台进行高通量的仿临床药效测试,以满足新药的临床商业价值预判及后续开发策略制定的需求,其后根据前期筛选的结果,使用PDX模型并结合毒理与PK实验,进行进一步的体内研究,是替身模型的最优应用思路。创模生物采用新一代替身模型建库方式,所建立的患者原代组织/细胞模型库可以同时满足体外高通量筛选和体内药效研究需求。更进一步,创模生物的PBMC-PDC体外共杀伤筛选平台,及PBMC-PDX双人源化模型,可有效满足当前在肿瘤免疫疗法研究中对于替身模型的需求。
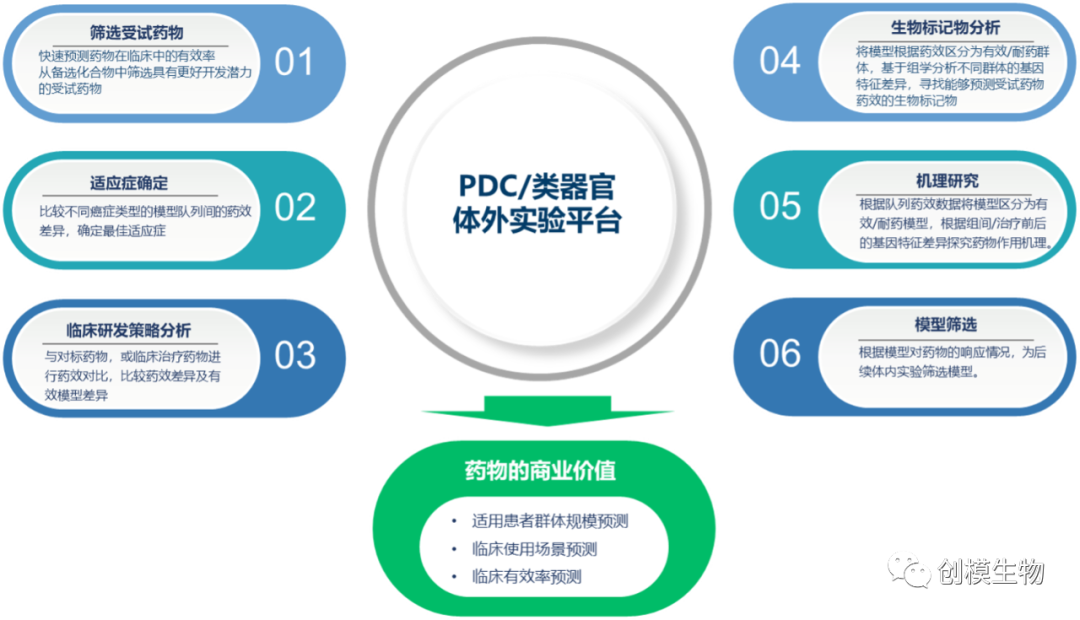
筛选受试药物:快速预测药物在临床中的有效率从备选化合物中筛选具有更好开发潜力的受试药物;
适应症确定:比较不同癌症类型的模型队列间的药效差异,确定最佳适应症;
临床研发策略分析:与对标药物,或临床治疗药物进行药效对比,比较药效差异及有效模型差异;
生物标记物分析:将模型根据药效区分为有效/耐药群体,基于组学分析不同群体的基因特征差异,寻找能够预测受试药物药效的生物标记物;
机理研究:根据队列药效数据将模型区分为有效/耐药模型,根据组间/治疗前后的基因特征差异探究药物作用机理;
模型筛选:根据模型对药物的响应情况,为后续体内实验筛选模型。
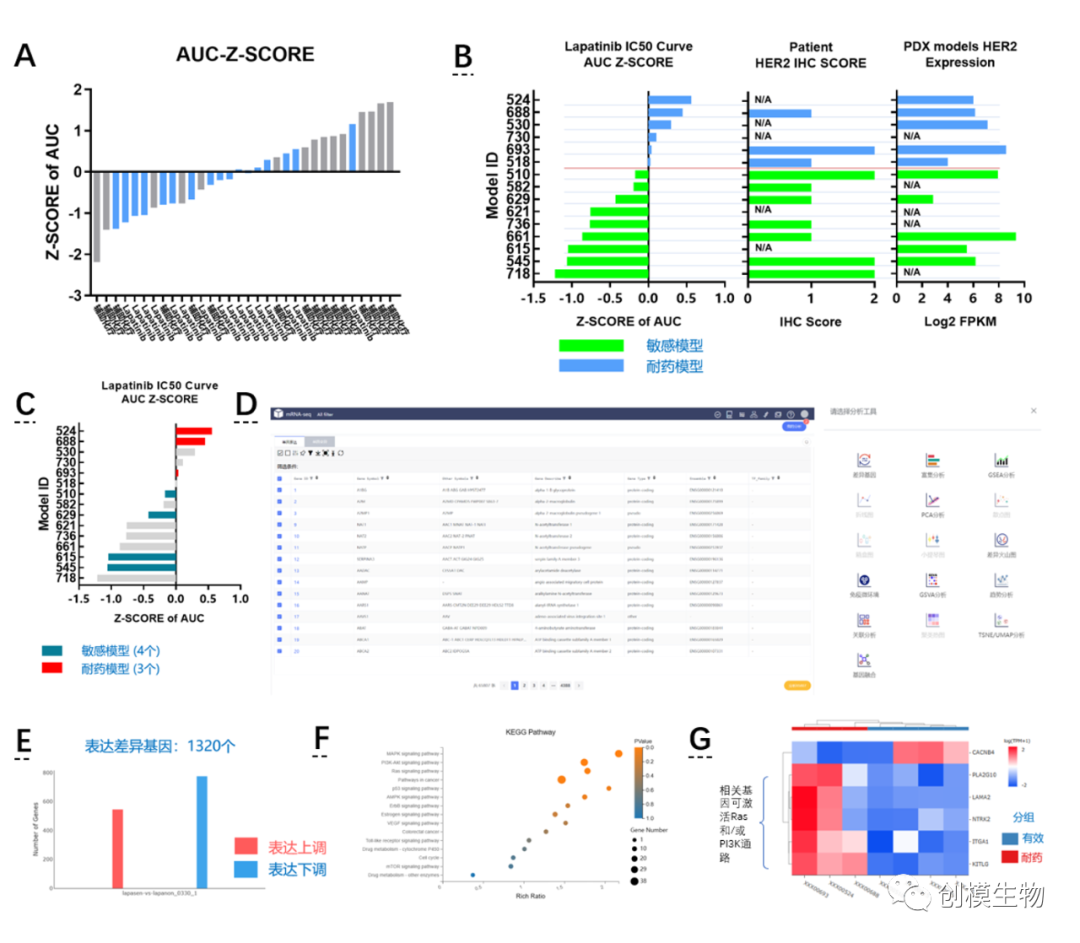
A: 在结直肠癌队列中比较标准化疗方案与拉帕替尼药效,B,拉帕提尼药效与HER2表达水平无关。C,选择部分模型进行基因分析。D,创模PDX模型数据库内建多种基因分析工具,可直接进行线上分析。E,拉帕提尼敏感组/耐药组基因表达差异。F基于差异表达基因进行信号通路富集分析,其中,PI3K、Ras、MAPK和Pathway in cancer信号通路在敏感与耐药模型之间有显著差异。G,对上述信号通路相关基因进行聚类分析,发现在耐药模型中普遍出现旁路激活情况。
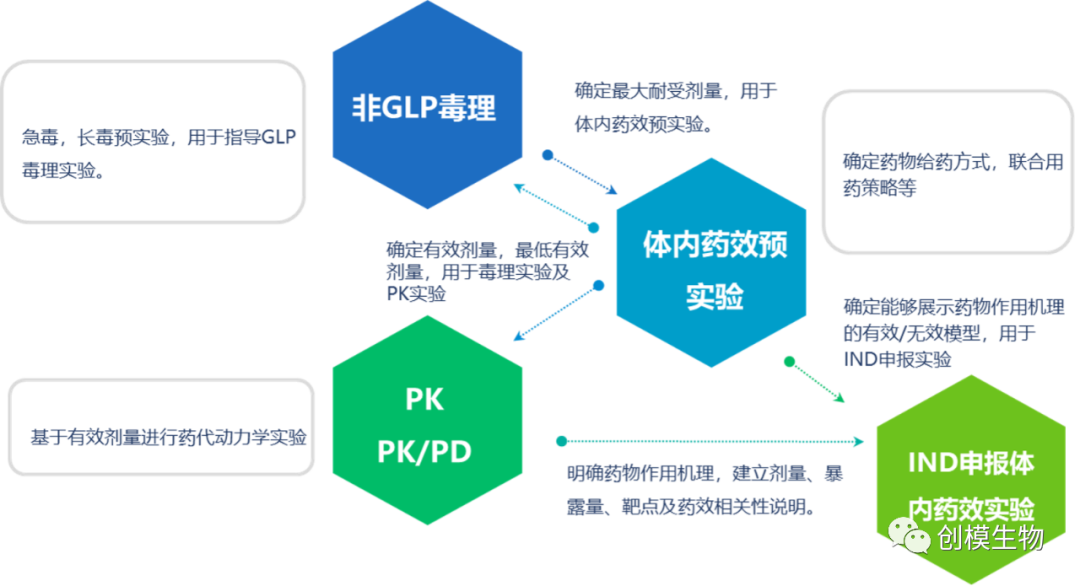
在体外实验确定适当模型后,相关模型可以立即用于体内研究阶段,包括:药效学实验、非GLP毒理、PK/PD实验。共同回答药物在生物体的最高耐受剂量、最低起效剂量、给药方式、联合用药方式等问题,并形成完整的IND申报数据包的一部分。
此外,该模型平台可与PBMC免疫系统人源化模型平台有机结合,用于免疫疗法相关研究。创模生物特有的PBMC-PDX双人源化模型平台可以在高度稳定的PDX模型重建的同时,在小鼠体内同时重建包括T细胞、NK细胞、DC细胞、巨噬细胞等在内的多种人免疫细胞,特别是T细胞与NK细胞的重建数量可以达到人体水平,结合创模生物的PBMC-PDC体外共杀伤平台,可以实现对免疫疗法的从体外到体内的全流程的替身模型开发路径,有效满足肿瘤免疫疗法新药研发者对使用替身模型进行药效测试的需求。

利用上述体内实验平台,您可以在新药研发中直接使用临床一致性更高的PDC/PDX部分或全部取代人源肿瘤细胞株。在不影响原有新药研发流程的基础上,以相近的投入同时获得药物在临床中的价值预测。相信这一平台将为您的新药研发助力,为提高新药研发的成功率做出贡献。
来源:创模生物
参考文献:1] Lee, J. K., et. al. (2018) Nature Genetics, 50(10), 1399–1411.
关于创模生物:创模生物科技(北京)有限公司位于昌平区云谷园,并在上海设有分公司。公司聚焦肿瘤及肿瘤免疫疗法的药效学CRO研究,并同时可以为新药研发企业提供PK、PK/PD、非GLP毒理等多种临床前研究的CRO评价服务。公司除了常规的同源模型、CDX模型以外,拥有iHuPBMC-T、iHuPBMC-NK\二代PDX模型平台、双人源化模型平台以及仿临床队列等独特的模型平台。创模生物致力于为肿瘤及肿瘤免疫疗法的创新者提供最具临床参考价值的临床前研究支持,助力产业的高速发展。
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。

