近期,HER2 ADC License-out交易频频发生,此般繁荣景象,难免不让人回忆起曾经PD-1出海的“盛况”。PD-1大军虽各有其志,但此后FDA“拒绝内卷”的信号释放,国产PD-1能否在FDA获批,至今还悬而未决。而HER2 ADC热度不亚于PD-1,当一款ADC被FDA拒绝,是否也释放了某种信号?拒掉一个HER2 ADC,让一众跻身于这条赛道的企业纷纷陷入沉思。5月15日,来自欧洲的Byondis公司宣布其HER2 ADC用于治疗HER2阳性乳腺癌的SYD985上市申请遭到了FDA的拒绝,理由是FDA需要更多的信息来支持审批决定。值得注意的是,SYD985是一个真正在结构和技术上很创新的产品,但最终落实到临床疗效上面却与HER2 ADC领域如今的“王者”DS-8201相形见绌,此类问题实际也是不少创新药面临的一大“通病”。“FDA拒绝批准HER2 ADC产品,无疑给行业浇了一盆冷水。”有业内人士向E药经理人这样表示,“在这一领域追赶的企业,都需要思索和正视手中的HER2 ADC是否还能走下去。”近两年来,合作金额动辄数十亿美元的ADC License-out交易让国内产业界对ADC出海信心倍增,产生了中国ADC能够与海外创新药一决高下的期望。国内处于研发阶段的HER2 ADC药物已有多款,尤其在乳腺癌这一适应证上的研发,已成了众兵家必争之地。激烈的竞争虽勿庸置否,但截至目前,FDA已经批准3款HER2 ADC获批上市,各自火热的同时,“天花板”级别的DS-8201更成了让多个产品难跃的鸿沟。而这一泼冷水倏然降临,虽降不了HER2 ADC场子的热,却能给予在场者一定提醒。这一结果让人不禁联想到一年前,中国PD-1的出海遇阻,原因是需要以更多临床数据用以支持审批。彼时,这一事件被认为是PD-1内卷式竞争的“滑铁卢”,而在Byondis被拒绝之际,其理由有着熟悉的味道,那HER2 ADC是否会步入PD-1后尘,终也要复刻PD-1的“悲剧”?为什么被拒绝?Byondis并没有过多披露FDA在CRL中回复的信息,主要表示公司还需要提供更多的信息来支持审批决定,且这些信息还需要额外的时间来审查。Byondis为此感到遗憾,表明了会继续推进SYD985在欧盟和英国的上市,但关于下一步是否要带着更多信息在FDA申请上市,暂未作出说明。不过有业内人士对E药经理人表示,Byondis被拒或许是因为临床数据无法呈现出更优的疗效,“他们的数据,完全被Enhertu吊打。”
(受访者提供)
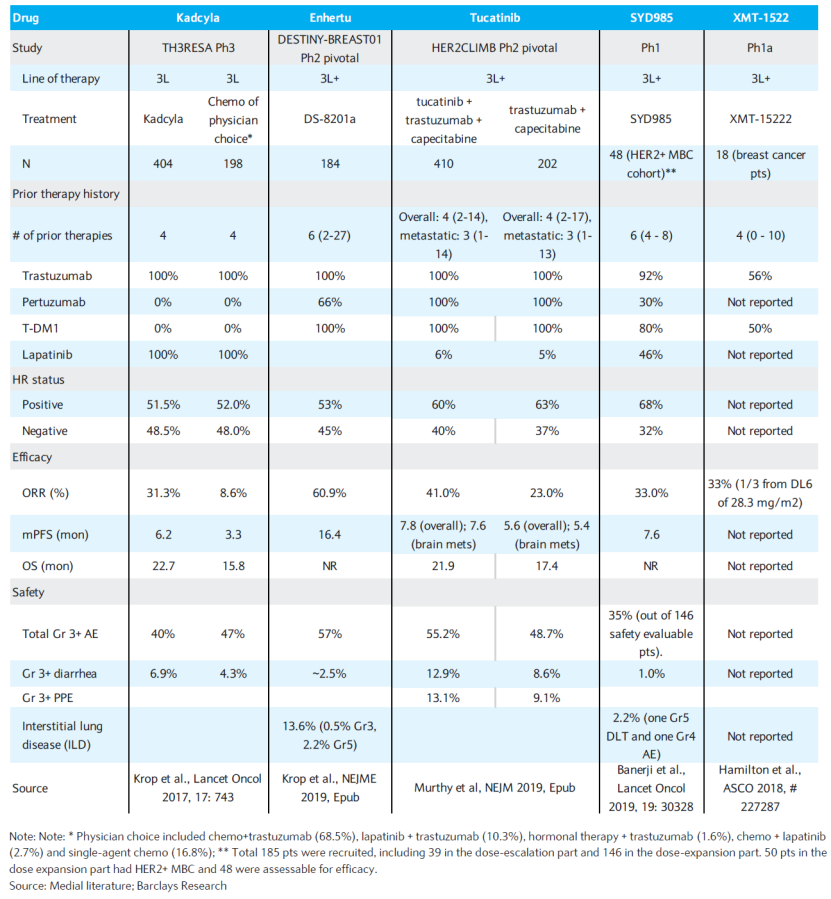
事实上,虽然在全球HER2 ADC已然成为研发热潮的当下,已上市产品仅有4款(包括在中国获批上市的维迪西妥单抗),而已经得到临床III期研究验证的HER2 ADC产品也并不算多。但SYD985,经历了十年征途之后,终于走到了III期验证这一步,且展现出了一定的应用前景。早在2018年1月,基于其I期临床试验数据,该产品就获得了FDA的快速通道认证,这在当时,无疑算得上是先行者。论起技术和创新度,SYD985值得被认可。该产品的研发采用了Byondis的duocarmazine连接子药物(Linker-drug,LD)创新技术平台。据了解,虽然早期的ADC药物能改善靶向性和细胞杀伤作用,但在血液循环中的稳定性不高,而基于LD技术平台研发出的ADC携带的细胞毒性药物一旦提前释放,会迅速自毁,从而限制对健康的损伤。此次SYD985的生物制剂许可申请是基于其关键的III期TULIP试验结果,数据显示:与医生选择治疗(PC)相比,在治疗不可切除的HER2+局部晚期或转移性乳腺癌患者的疗效时,SYD985组目标患者的PFS显著延长(7.0 vs 4.9个月;HR=0.64;P=0.002),达到了试验的主要终点,不过两组之间的OS、ORR和HRQoL数据没有特别显著的差异。从技术和创新度的思维范畴中跳出来,放到临床的角度来看,SYD985比起同行中Enhertu(DS-8201)和Kadcyla(T-DM1)这两大珠玉,其优势却是愈发弱化。T-DM1是第一个获批HER2阳性晚期乳腺癌适应证的ADC药物,获批时连ADC产品都没几个,不错的数据加之稀缺性,使得T-DM1快速获批上市。而DS-8201的问世更是刷新了HER2 ADC在乳腺癌领域的“天花板”,2021年ESMO大会公布的临床研究DESTINY-Breast01(DB01)最终数据显示,针对既往平均接受过6线治疗的患者,DS-8201的客观缓解率(ORR)高达62.0%,中位PFS长达 19.4 个月,中位OS长达29.1个月。由于惊艳的疗效,FDA在2019年即批准了DS-8201用于HER2阳性晚期乳腺癌的三线及三线以后的治疗。之后DS-8201又与T-DM1做了头对头对比,成功挑战彼时二线治疗标准T-DM1,成为新的二线治疗标准。也就是说,今时不同往日,眼下的情况是DS-8201几乎改变了HER2阳性乳腺癌二线乃至整体的治疗格局,市场已经见识到了DS-8201的惊艳,SYD985要想挤入强者的领地,还是需要拿出显著差异化的数据。HER2 ADC被FDA拒绝批准,听起来和来自中国的PD-1被FDA拒绝的故事似乎殊途同归,不免让人心生疑虑,中国的HER2 ADC出海是否也会重蹈PD-1覆辙?时间回到2022年年初,信达生物收到了FDA的完整回复函,其中建议信迪利单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。也就是说,FDA希望信达生物给出信迪利单抗对比美国市场一线NSCLC标准疗法疗效更优的临床数据以支持批准,实际上这是一个“反内卷”的行为。美国市场分析人士李腾认为,适度的竞争是创新的必要但不充分条件,良性竞争能卷出既有疗效优势又有价格优势的产品,过度卷的话就变成资本与资源的极大浪费,进而伤害整个领域的长期发展。现如今中国的ADC出海正值火热,前有荣昌生物与Seagen合作HER2 ADC维迪西妥单抗,后有科伦博泰百亿美元合作默沙东,进入2023年以来License-out交易已达20笔,光ADC领域的License-out交易就占据四成,上周又诞生了一笔HER2 ADC的License-out交易,百力司康生物以20亿美元将BB-1701的全球权益授权给卫材。值得注意的是,全球在研HER2 ADC产品已经有70余种,更是诞生了AZ/第一三共的DS-8201这样一款疗效难以超越的BIC产品。有业内人士认为,“不论如何,FDA拒绝批准HER2 ADC产品,无疑是给行业浇了一盆冷水。他们需要思索和正视手中的HER2 ADC是否还能走下去,说故事的时代已经过去,要看到严峻的形势,懂得及时止损。前有PD-1企业暂停大三期临床,数十亿元打水漂,如今的HER2 ADC要谨慎对待。”其实不然,经历2022年的出海遇阻,中国制药企业们也已经形成了一个共识——出海美国,要么证明疗效更优,要么争取突破性疗法。例如荣昌生物的维迪西妥单抗治疗含铂化疗后局部晚期或转移性尿路上皮癌适应证,就获得了FDA的突破性疗法及快速通道资格认定。不过归根结底,中国的HER2 ADC出海,依然还是要看数据是不是足够优秀,有和已上市产品同场竞技的可能。李腾告诉E药经理人,在海外,尤其是美国市场,“一期临床数据是达成大额交易的必要条件。”例如与BioNTech达成两款ADC药物授权合作的映恩生物,里程碑付款超15亿美元,预付款有1.7亿美元。DB-1303作为两家公司合作的项目之一,虽然是研发扎堆儿的HER2靶点,但已于2023年1月12日获得FDA授予的快速通道认定,用于治疗HER2过表达的晚期、复发或转移性子宫内膜癌。2022年,强生/传奇合作的西达基奥仑赛验证了这一观点,在临床数据中处处展现BIC的潜力。作为全球第二款获批上市的BCMA CAR-T,虽然并未与BMS/蓝鸟的Abecma做头对头试验,但在关键性CARTITUDE-1 研究中,西达基奥仑赛治疗末线主要终点总缓解率 ORR / 完全缓解率(s)CR 达 98%/78%,而 Abecma 为 72%/39%,有明显的优势。不过,固然目前有足够证据证明疗效显著的同靶点、同适应证产品能够受到FDA的认可,明显劣效产品是FDA拒绝的直接理由,但是对于研发扎堆儿的靶点,FDA的态度其实并不明确。君实生物的特瑞普利单抗虽然针对美国市场治疗手段有限的鼻咽癌适应证,但却因“审评周期内无法进行现场核查”使得审评节点一推再推。有业内人士告诉E药经理人,目前很难判断FDA的态度是否明朗,因为PD-1核查一直悬而未决,没说不可以也没说可以,需要等待明确的信号。
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充。如需转载,请注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言。
来源:E药经理人 ,作者Erin 润屿