自20世纪80年代以来,我国一直实行药品上市许可与生产许可合并的管理模式。2015年MAH制度相关法规政策出台,逐步形成了以药品上市许可持有人制度为中心的新制度,优化了药品注册与生产许可“捆绑”模式的弊端。MAH制度在欧盟、美国和日本已实施多年,通过上市前MAH申请规范、审批要求、上市后药物警戒要求、安全性研究、赔偿保障能力对比,为我国MAH配套监督制度作出参考。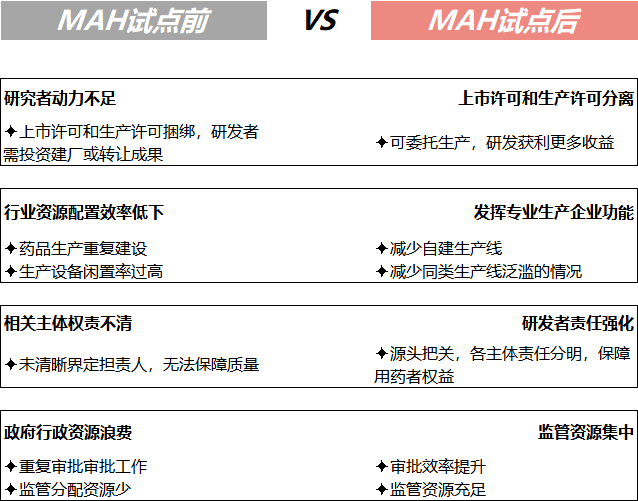
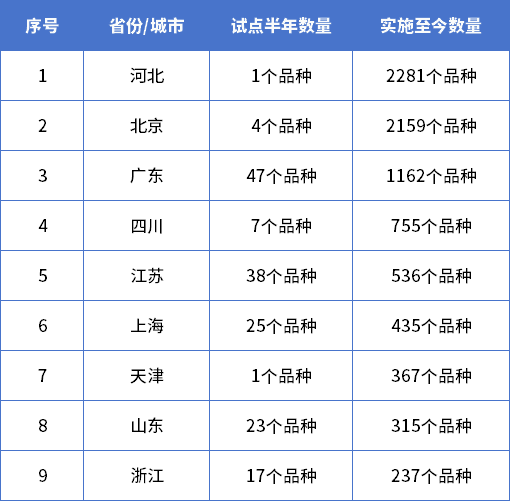
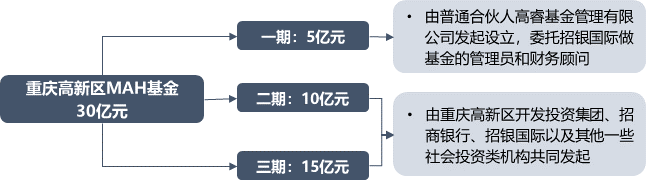
截至目前,按药品批准文号统计MAH品种共25864个,其中十省市中河北省MAH批准文号数量最多,批准文号涵盖2281个品种,北京、广东紧跟其后。MAH药品类型方面,化药、中药、生物制品分别为16981个、8386个和497个,企业主要分布在河北、北京、广东等地。国内MAH试点工作开启后,齐鲁制药有限公司的吉非替尼首仿药率先获益,成为首个MAH试点落地品种。该品种的上市可打破进口药企的市场垄断,降低抗癌药物价格,提高国内肺癌患者用药可及性。按照MAH试点方案要求,试点行政区域内的药品生产企业整体搬迁或者被兼并后整体搬迁的,该企业持有药品批准文号的药品可以申请MAH。当时奇星药业厂区属于征拆范围,在政策红利下,奇星药业申请成为公司75个中药品种的MAH,即可委托其他符合条件的企业进行生产,从而避免处于停产困境。MAH制度使得医药市场要素灵活流动,通过实现所有权和生产分离,推动行业CRO、CMO及CSO发展,中国医药生态环境下研发、生产和销售等各领域企业生产关系与市场结构产生巨大变化。同时,医疗器械注册人制度全面实施,医疗器械技术落地产品化的方式可由原先的自建厂房或寻求生产合作方转变为选择现有生产企业或专业CMO/CDMO平台进行委托生产。上海:采取“专项风险保险基金+保险”风险救济制度,由上海张江管委会出资5000万元委托第三方对企业购买的保险进行运营管理,明确对注册在张江高科技园区核心区内的持有人和受托生产企业提供先行风险理赔,还有保费补贴。北京中关村:对参与药品上市许可持有人制度试点/医疗器械注册人制度试点的企业给予保费补贴支持。按照所投药品/医疗器械临床试验责任保险、药品/医疗器械质量综合责任保险及其附加险等保费80%的比例给予补贴支持,每年每家企业给予最高不超过100万元的资金支持。江苏:加大力度推进药品上市许可持有人制度试点工作,鼓励有条件的地区设立相关专项基金和风险担保基金,并在人才引进、科研立项、成果转化等方面优先扶持。苏州工业园:设置总额5000万元的风险保障资金、总额1000万元的药品注册奖励资金,鼓励企业试点MAH制度。重庆:国内首支MAH专项基金重庆高新区MAH基金。来源:药智产业观察 ,作者杨文
声明:本文观点仅代表作者本人,不代表煜森资本立场,欢迎在留言区交流补充。如需转载,请注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言。